题目内容
【题目】实验测得0.1mol·L-1NH3·H2O溶液、0.1mol·L-1NH4Cl溶液以及H2O的pH随温度的变化曲线如图所示。下列说法正确的是( )
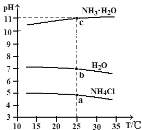
A. 随温度升高,H2O逐渐由弱碱性转变为酸性
B. 25℃时,NH3·H2O的电离常数 Kb≈10-5
C. 水的离子积常数:a点>b点>c点
D. NH3·H2O溶液和NH4Cl溶液pH随温度变化趋势不同,是因为平衡移动方向不同
【答案】B
【解析】
A. 随温度升高,H2O的pH值减小,但水电离出的氢离子浓度始终等于氢氧根离子浓度,始终为中性。A错误;
B. 25℃时,NH3·H2O的pH=11,即c(H+)=10-11,c(OH-)=10-3电离产生的c(NH4+)= c(OH-)则电离常数 Kb=10-3ⅹ10-3/10-1≈10-5,B正确;
C. 相同温度下,水的离子积常数不变:a点=b点=c点,C错误;
D. NH3·H2O溶液和NH4Cl溶液pH随温度变化趋势不同,是因为NH3·H2O溶液以电离为主,溶液显碱性;NH4Cl溶液是水解平衡,溶液显酸性。平衡移动方向是相同的,D错误;
答案选B。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】二甲醚(CH3OCH3)是一种新型能源。
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=﹣99kJ·mol-1
CH3OH(g) △H1=﹣99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=﹣41kJ·mol-1
CO2(g)+H2(g) △H3=﹣41kJ·mol-1
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式_____。
(2)下列既能提高反应①中 CO 的平衡转化率,又能增大反应速率的是____(填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
(3)在某恒温恒容容器中发生反应③,能说明该反应达到平衡的是___(填标号)。
a.气体平均相对分子质量保持不变
b.△H3保持不变
c.![]() 保持不变
保持不变
d.气体密度保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中通入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3 的物质的量分数[φ(CH3OCH3)]与反应时间(t)有关数据如表所示。
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
φ(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①该温度下,上述反应的平衡常数K为___(用分数表示)。
②反应速率v=v正﹣v逆,其中v正=k正·φ2(CH3OH)、v逆=k逆·φ(CH3OCH3)·φ(H2O),k正、k 逆分别为正、逆反应速率常数,![]() 只与温度有关。15min时,=___(结果保留2位小数)。
只与温度有关。15min时,=___(结果保留2位小数)。
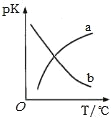
(5)在密闭容器中发生反应③,平衡常数为K。pK(pK=﹣lgK)与温度的关系如图所示,图中曲线___(填“a”或“b”)能反映平衡常数变化趋势。