题目内容
【题目】如下左图所示,其中甲池的总反应式为2CH3OH+302+4KOH=2K2CO3+6H20,完成下列问题:
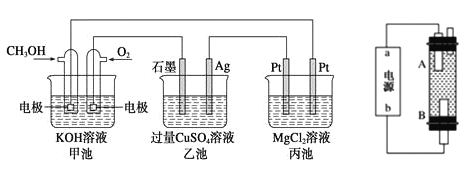
(1)甲池燃料电池的负极反应为___________________。
(2)写出乙池中电解总反应的化学方程式: ___________________。
(3)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生____g沉淀,此时乙池中溶液的体积为400mL,该溶液的pH=____________。
(4)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2 的实验装置(如上右图)。若用于制漂白液,a 为电池的______极,电解质溶液最好用_____。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___作电极。
【答案】 CH3OH-6e-+8OH-+8OH-=CO32-+6H2O 2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑ 1.16 1 负 饱和食盐水 铁(Fe)
2Cu+2H2SO4+O2↑ 1.16 1 负 饱和食盐水 铁(Fe)
【解析】(1)甲醇的燃料电池,甲醇在负极发生氧化反应,在碱性环境下变为碳酸根离子,极反应:CH3OH-6e-+8OH-=CO32-+6H2O;正确答案:CH3OH-6e-+8OH-=CO32-+6H2O。
(2)乙池为电解池,石墨做阳极,银做阴极;阳极极反应4OH--4e-=O2↑++2H2O,阴极极反应2Cu2++4e-=2Cu,两个反应相加,为总反应2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑;正确答案:2CuSO4+2H2O
2Cu+2H2SO4+O2↑;正确答案:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑。
2Cu+2H2SO4+O2↑。
(3)丙池中用惰性电极电解氯化镁溶液总反应为MgCl2+2H2O==Mg(OH)2↓+Cl2↑+H2↑;甲池为原电池,总反应为2CH3OH+302+4KOH=2K2CO3+6H20,根据串联电路转移电子数相等规律可知:12e---6Mg(OH)2,12 e---3O2,消耗0.01molO2最终产生Mg(OH)20.02 mol,质量为0.02×58=1.16g;乙池反应2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,根据电子转移相等规律,根据关系式4e---2H2SO4可知,甲池转移电子为0.04 mol,乙池中产生H2SO40.02 mol,c(H+)=0.02×2÷0.4=0.1mol/L, 该溶液的pH=1,正确答案:1.16 ;1。
2Cu+2H2SO4+O2↑,根据电子转移相等规律,根据关系式4e---2H2SO4可知,甲池转移电子为0.04 mol,乙池中产生H2SO40.02 mol,c(H+)=0.02×2÷0.4=0.1mol/L, 该溶液的pH=1,正确答案:1.16 ;1。
(4)用惰性电极电解饱和食盐水,阳极产生氯气,阴极产生氢气,同时生成氢氧化钠溶液,氯气与氢氧化钠溶液反应生成次氯酸钠和氯化钠即为漂白液,所以a 为电池的负极,A处生成氢氧化钠溶液,B处产生氯气,直接反应生成漂白液;要产生Fe(OH)2,硫酸钠溶液作电解质,阳极材料为铁,失电子变为亚铁离子,才能够提供亚铁离子;正确答案:饱和食盐水;铁(Fe)。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】二甲醚(CH3OCH3)是一种新型能源。
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=﹣99kJ·mol-1
CH3OH(g) △H1=﹣99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=﹣41kJ·mol-1
CO2(g)+H2(g) △H3=﹣41kJ·mol-1
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式_____。
(2)下列既能提高反应①中 CO 的平衡转化率,又能增大反应速率的是____(填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
(3)在某恒温恒容容器中发生反应③,能说明该反应达到平衡的是___(填标号)。
a.气体平均相对分子质量保持不变
b.△H3保持不变
c.![]() 保持不变
保持不变
d.气体密度保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中通入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3 的物质的量分数[φ(CH3OCH3)]与反应时间(t)有关数据如表所示。
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
φ(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①该温度下,上述反应的平衡常数K为___(用分数表示)。
②反应速率v=v正﹣v逆,其中v正=k正·φ2(CH3OH)、v逆=k逆·φ(CH3OCH3)·φ(H2O),k正、k 逆分别为正、逆反应速率常数,![]() 只与温度有关。15min时,=___(结果保留2位小数)。
只与温度有关。15min时,=___(结果保留2位小数)。
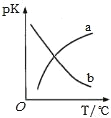
(5)在密闭容器中发生反应③,平衡常数为K。pK(pK=﹣lgK)与温度的关系如图所示,图中曲线___(填“a”或“b”)能反映平衡常数变化趋势。