题目内容
18.25℃时,0.1mol•L-1氨水中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,下列叙述正确的是( )| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11mol•L | |
| B. | pH=7的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)>c(H+)=c(OH-) | |
| C. | 浓度均为0.1mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 0.1mol•L-1的氨水与0.05mol的H2SO4溶液等体积混合后所得溶液中:2c(NH4+)+2c(NH3•H2O)=c(SO42-) |
分析 A、25℃时,0.1mol•L-1氨水中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,KW=1×10-14,所以c(H+)=1×10-11mol/L,c(OH-)=1×10-3mol/L;
B、据电荷守恒分析;
C、NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中铵根离子的水解程度小于一水合氨的电离程度;
D、在0.1mol•L-1的氨水与0.05mol的H2SO4溶液等体积混合后所得溶液中溶质为(NH4)2SO4.
解答 解:A、25℃时,0.1mol•L-1氨水中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,KW=1×10-14,所以c(H+)=1×10-11mol/L,c(OH-)=1×10-3mol/L,故A正确;
B、在pH=7的NH4Cl和NH3•H2O的混合溶液,c(Cl-)=c(NH4+)>c(H+)=c(OH-),故B错误;
C、浓度均为0.1mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中铵根离子的水解程度小于一水合氨的电离程度,所以c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),故C正确;
D、在(NH4)2SO4溶液中,c(NH4+)+c(NH3•H2O)=2c(SO42-),故D错误;
故选AC.
点评 本题考查了据水的离子积常数计算溶液中氢离子浓度、电荷守恒、溶液中离子浓度大小比较,题目难度不大.

练习册系列答案
相关题目
8.下列有关甲烷的叙述不正确的是( )
| A. | 甲烷是最简单的有机物 | |
| B. | 甲烷是天然气的主要成分 | |
| C. | 甲烷能与氯气在光照条件下发生反应 | |
| D. | 甲烷能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色 |
6.下列有关物质的性质与应用对应关系不正确的是( )
| A. | 锂质量轻、比能量大,可用作电池负极材料 | |
| B. | 某地雨水经过一段时间,其pH由4.68降为4.28,因为水中溶解了较多的CO2 | |
| C. | 酒精是良好的有机溶剂,可洗去皮肤表面沾有的苯酚 | |
| D. | 漂白粉在水溶液中能够生成次氯酸,可用于漂白纸张 |
13.下表中对离子方程式的评价不合理的是( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通入少量的SO2:ClO-+H2O+SO2═Cl-+SO42-+2H+ | 错误,碱性介质中 不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | 正确 |
| C | NH4Al(SO4)2溶液中滴入几滴NaOH溶液:NH4++OH-═NH3•H2O | 错误,OH-首先和Al3+反应 生成Al(OH)3沉淀 |
| D | 用惰性电极电解MgCl2溶液:2Mg2++2H2O $\frac{\underline{\;电解\;}}{\;}$ 2Mg+O2↑+4H+ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
3.如图为铜-锌-稀硫酸原电池示意图,下列表述正确的是( )
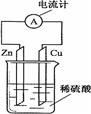

| A. | 电子由铜片通过导线流向锌片 | B. | 正极上的反应为Zn-2e-═Zn2+ | ||
| C. | 反应一段时间后,溶液的pH变小 | D. | 原电池的反应本质是氧化还原反应 |
10.浓硫酸是实验室必备的重要试剂,下列有关它的说法不正确的是( )
| A. | 具有强腐蚀性 | B. | 能用于干燥氨气 | ||
| C. | 能使蔗糖变黑 | D. | 加热时能与铜发生反应 |
7.下列关于化学反应与能量的说法不正确的是( )
| A. | 在化学反应中,断开化学键要吸收能量,形成化学键要放出能量 | |
| B. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| C. | 若反应物的总能量高于生成物的总能量,则该反应必为吸热反应 | |
| D. | 铝热反应是放热反应 |
8.由两种饱和一元醇(分子中没有不饱和键,只有一个羟基)组成的混合物,经测定质量为0.78g,该混合物与足量钠反应生成224mL H2(标准状况),则两种醇的分子式是( )
| A. | CH3OH,C3H7OH | B. | C2H5OH,C3H7OH | C. | C3H7OH,C4H9OH | D. | C2H5OH,C4H9OH |