题目内容
3.如图为铜-锌-稀硫酸原电池示意图,下列表述正确的是( )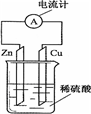
| A. | 电子由铜片通过导线流向锌片 | B. | 正极上的反应为Zn-2e-═Zn2+ | ||
| C. | 反应一段时间后,溶液的pH变小 | D. | 原电池的反应本质是氧化还原反应 |
分析 锌比铜活泼,锌为负极,铜为正极,负极反应为Zn-2e-=Zn2+,正极反应为2H++2e-=H2↑,以此解答该题.
解答 解:A.锌比铜活泼,锌为负极,铜为正极,电子由锌片通过导线流向铜片,故A错误;
B.锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,故B错误;
C.正极反应为2H++2e-=H2↑,溶液消耗氢离子,溶液pH增大,故C错误;
D.原电池是自发的氧化还原反应,故D正确.
故选D.
点评 本题考查原电池知识,侧重于学生的分析能力的考查,注意把握原电池的工作原理和电极方程式的书写,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列有关硫酸和硝酸的叙述正确的是( )
| A. | 在加热条件下,浓硫酸和浓硝酸均能与木炭反应 | |
| B. | 将浓硫酸和浓硝酸分别长期露置于空气中,浓度均会升高 | |
| C. | 稀硫酸和稀硝酸分别与金属反应时,S和N元素的化合价都会发生变化 | |
| D. | 因为浓硫酸和浓硝酸都能与铝反应,所以常温下二者都不能用铝制容器盛放 |
14.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| B. | 玻璃钢是钢与玻璃纤维形成的复合材料 | |
| C. | 石油化工废弃物易造成水体富营养化 | |
| D. | 硫酸铵是常用的一种硝态氮肥 |
18.25℃时,0.1mol•L-1氨水中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,下列叙述正确的是( )
| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11mol•L | |
| B. | pH=7的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)>c(H+)=c(OH-) | |
| C. | 浓度均为0.1mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 0.1mol•L-1的氨水与0.05mol的H2SO4溶液等体积混合后所得溶液中:2c(NH4+)+2c(NH3•H2O)=c(SO42-) |
8.下列叙述中,正确的是( )
| A. | 金属钠着火时,可以用二氧化碳灭火 | |
| B. | 可将金属钠存放在煤油或四氯化碳中 | |
| C. | 金属钠投入到CuSO4 溶液中,不能置换出单质铜 | |
| D. | 钠在氧气中燃烧观察到的现象是:金属钠熔化,火焰黄色,生成白色固体 |
15.下列元素不属于长周期元素的是( )
| A. | Cs | B. | Cl | C. | Fe | D. | Br |
12.下列实验操作、现象、结论均正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 淀粉溶液中加入碘水 | 溶液变蓝 | 说明淀粉没有水解 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 向某未知溶液中加入BaCl2溶液后,再加入稀硝酸观察 | 沉淀的生成 | 检验是否含SO42- |
| D | 向某未知溶液中加入NaOH浓溶液,加热,在试管口用湿润的蓝色石蕊试纸检验 | 试纸变红 | 检验是否含NH4+ |
| A. | A | B. | B | C. | C | D. | D |