题目内容
10.浓硫酸是实验室必备的重要试剂,下列有关它的说法不正确的是( )| A. | 具有强腐蚀性 | B. | 能用于干燥氨气 | ||
| C. | 能使蔗糖变黑 | D. | 加热时能与铜发生反应 |
分析 依据浓硫酸具有酸性、吸水性、脱水性和强氧化性等性质分析解答.
解答 解:A.浓硫酸具有酸性、脱水性和强氧化性,所以具有强腐蚀性,故A正确;
B.浓硫酸具有酸性,能够与氨气反应,不能干燥氨气,故B错误;
C.浓硫酸具有脱水性,能使蔗糖中H、O元素以2:1水的形式脱去而体现脱水性,从而使蔗糖变黑,故C正确;
D.浓硫酸具有强氧化性,加热条件下,能和Cu发生氧化还原反应,故D正确;
故选:B.
点评 本题考查了浓硫酸的性质,浓硫酸的强氧化性、脱水性是考查高频点,注意吸水性和脱水性区别,题目难度不大.

练习册系列答案
相关题目
20.下列反应中,属于加成反应的是( )
| A. | 乙醇与金属钠反应 | B. | 苯和液溴反应生成溴苯 | ||
| C. | 乙烯和溴的四氯化碳溶液反应 | D. | 乙酸和乙醇反应生成乙酸乙酯 |
1.下列有关物质应用的说法错误的是( )
| A. | 用食醋清洗热水瓶中的水垢 | |
| B. | 工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的 | |
| C. | 氢氧化铝可用于治疗胃酸过多 | |
| D. | 为了延长果实或花朵的成熟期,可用浸泡过高锰酸钾溶液的硅土吸收水果或花朵产生的乙烯 |
18.25℃时,0.1mol•L-1氨水中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,下列叙述正确的是( )
| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11mol•L | |
| B. | pH=7的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)>c(H+)=c(OH-) | |
| C. | 浓度均为0.1mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 0.1mol•L-1的氨水与0.05mol的H2SO4溶液等体积混合后所得溶液中:2c(NH4+)+2c(NH3•H2O)=c(SO42-) |
5.下列金属中,与盐酸或氢氧化钠溶液都能放出氢气的是( )
| A. | Al | B. | Cu | C. | Fe | D. | Mg |
15.下列元素不属于长周期元素的是( )
| A. | Cs | B. | Cl | C. | Fe | D. | Br |
2.下列说法正确的是( )
| A. | 可用苯萃取四氯化碳中的碘 | |
| B. | 苯滴入溴水中,发生取代反应生成溴苯 | |
| C. | 可用石蕊溶液区分乙醇和乙酸两种物质 | |
| D. | 等物质的量的甲烷与氯气混合光照至充分反应,产物中最多的是四氯化碳 |
19.下列有关说法正确的是( )
| A. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | Na2O2与CO2反应生成标况下11.2L O2,反应过程中转移电子数1 NA | |
| D. | 反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4该反应FeS2中的硫元素全部被氧化 |
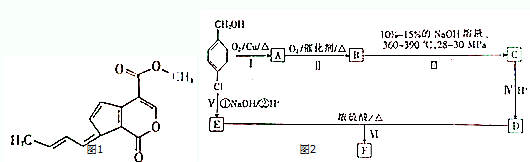
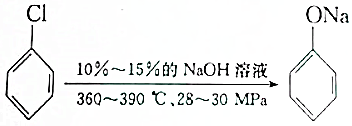
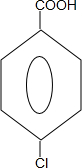 ;
;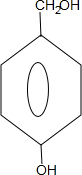 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$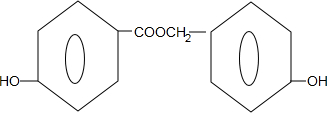 +H2O.
+H2O.