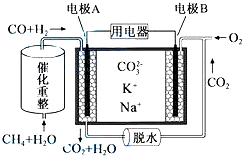
题目内容
16.下列叙述中错误的是( )| A. | 金属性:Na>Mg>Al | B. | 原子半径:Cl>Si>O | ||
| C. | 熔点:SiO2>NaCl>SO2 | D. | 酸性:HClO4>H2SO4>H2CO3 |
分析 A、同一周期元素,元素金属性随着原子序数增大而减弱;
B、同一周期内,原子半径随着原子序数增大而减小;
C、一般来说晶体的熔点:原子晶体>离子晶体>分子晶体,结构相似的分子晶体,相对分子质量越大,熔点越高;
D、元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A、同一周期元素,元素金属性随着原子序数增大而减弱,所以金属性Na>Mg>Al,故A正确;
B、同一周期内,原子半径随着原子序数增大而减小,所以原子半径Cl<Si,故B错误;
C、SiO2、NaCl、SO2分别为原子晶体、离子晶体、分子晶体,一般来说晶体的熔点:原子晶体>离子晶体>分子晶体,则晶体的熔点SiO2>NaCl>SO2,故C正确;
D、元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>C,所以酸性:HClO4>H2SO4>H2CO3,故D正确,故选B.
点评 本题考查同一周期元素金属性、非金属性、氢化物的稳定性、原子半径等元素周期律的应用,以第三周期为例熟练掌握同一周期元素原子结构及性质递变规律,题目难度不大.

练习册系列答案
相关题目
6.下列各组分子中,中心原子均采取sp3不等性杂化的是( )
| A. | PCl3、NH3 | B. | BF3、H2O | C. | CCl4、H2S | D. | BeCl2、BF3 |
4.下列有关物质结构的表述正确的是( )
| A. | 乙酸的比例模型: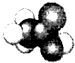 | B. | CO2的电子式: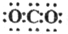 | ||
| C. | 乙醛结构简式:CH3COH | D. | 氯原子的结构示意图: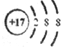 |
11.下列四种烃的名称所表示的物质,命名正确的是( )
| A. | 2-甲基-2-丁烯 | B. | 2-乙基丙烷 | ||
| C. | 3-甲基-2-丁烯 | D. | 2,2-二甲基-3-戊炔 |
1.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | 标准状况下,11.2 L的SO3所含分子数为0.5NA | |
| D. | 室温下,8 g甲烷含有共价键数为2NA |
8.常温下,下列各组离子一定能大量共存的是( )
| A. | c(OH-)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br - | |
| B. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | c(OH-)/c(H+)=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的c(H+)=1.0×10-13 mol/L的溶液中:K+、NH4+、AlO2-、HCO3- |
6.下列有关物质的性质与应用均正确的是( )
| A. | SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力 | |
| B. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| C. | MgO、Al2O3的熔点很高,二者都可用于制作耐高温材料 | |
| D. | 氨气是一种碱性气体,可用碱石灰或无水CaCl2干燥 |