题目内容
4.下列有关物质结构的表述正确的是( )| A. | 乙酸的比例模型: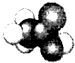 | B. | CO2的电子式: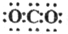 | ||
| C. | 乙醛结构简式:CH3COH | D. | 氯原子的结构示意图: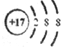 |
分析 A.比例模型主要体现的是组成该分子的原子间的大小关系;
B.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
C.乙醛的结构简式中醛基书写错误;
D.氯元素核电荷数是17,最外层电子数是7.
解答 解:A.乙酸分子中含有甲基碳原子连接羧基碳原子,其比例模型为 ,故A正确;
,故A正确;
B.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故B错误;
,故B错误;
C.乙醛的结构式为: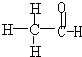 ,结构简式为:CH3CHO,故C错误;
,结构简式为:CH3CHO,故C错误;
D.氯原子的结构示意图为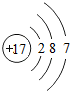 ,故D错误;
,故D错误;
故选A.
点评 本题考查了化学用语,知道电子式、结构简式、原子的结构示意图的书写,知道比例模型及球棍模型的区别是解答关键,易错选项是B,注意CO2碳原子和氧原子之间有2对电子,为易错点,题目难度中等.

练习册系列答案
相关题目
14.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率( )
| A. | V(H2O)=0.003mol/(L•S) | B. | V(NH3)=0.003mol/(L•S) | ||
| C. | V(NH3)=0.002mol/(L•S) | D. | V(O2)=0.005mol/(L•S) |
15.下列关于粒子结构的描述不正确的是( )
| A. | CH3CH(NO2)COOH分子中含有“手性碳原子” | |
| B. | HS-和HC1均是含一个极性键的18电子粒子 | |
| C. | 当用带有静电的玻璃棒接近CH2Cl2和CC14液体细流时,细流都不发生偏转 | |
| D. | 1mol己烷含有的共价键数目为19NA(NA代表阿伏加德罗常数) |
12.从下列实验事实所得出的相应结论不正确的是( )
| 实验事实 | 结论 | |
| A | 铁与硫单质生成FeS,与Cl2生成FeCl3 | 氧化性:Cl2>S |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊(H2SiO3) | 酸性:H2CO3>H2SiO3 |
| C | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| D | 某无色溶液加入盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液一定有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
19.研究表明:多种海产品体内含有+5价的砷(As)元素,对人体无毒,而砒霜的成分是As2O3,有剧毒;青菜中含有维生素C.专家忠告:不要同时大量食用海鲜和青菜,否则容易中毒.下面有关解释正确的是( )
| A. | As2O3中As元素为+3价 | B. | 维生素C能将+5价砷还原成As2O3 | ||
| C. | 致人中毒过程中砷发生氧化反应 | D. | 维生素C具有氧化性 |
9.下列离子方程式书写正确的是( )
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
16.下列叙述中错误的是( )
| A. | 金属性:Na>Mg>Al | B. | 原子半径:Cl>Si>O | ||
| C. | 熔点:SiO2>NaCl>SO2 | D. | 酸性:HClO4>H2SO4>H2CO3 |
13.哈伯因发明用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生N2+3H2?2NH3.下列说法正确的是( )
| A. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| B. | 达到化学平衡时,N2完全转化为NH3 | |
| C. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 | |
| D. | 单位时间内消耗a mol N2同时消耗2amol NH3,说明该反应已达到平衡状态 |
14.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 | |
| B. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ•mol-1 | |
| C. | 已知中和热为57.3 kJ•mol-1,若将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量要大于57.3 kJ | |
| D. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l);△H<0 |