题目内容
7.煤、天然气是社会生产、生活中重要的能源.(1)工业上常把煤进行气化和液化处理,使煤变成清洁能源.煤气化和液化流程示意图如下:

①已知H2、CO和CH3OH的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.写出由CO和H2合成甲醇的热化学方程式CO (g)+2H2(g)═CH3OH (l)△H=-128.1kJ/mol
②煤进行气化和液化的优点是利用率高,污染小
(2)天然气催化重整也可生成CO和H2
①500℃,向一体积可变的密闭容器中充入一定量CH4和水蒸气进行催化重整,下列能说明反应一定处于平衡状态的是AD
A.混合气体的密度不随时间变化 B.CO和H2的体积分数之比不随时间变化
C.V正(CH4)=3v逆(H2) D.混合气体的平均相对分子质量不随时间变化
②CO和H2可用作燃料电池.一种熔融碳酸盐燃料电池原理示意如图:
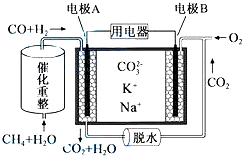
写出A电极反应式H2+CO32--2e-=H2O+CO2 CO-2e-+CO32-=2CO2或H2+2CO+CO32--2e-=H2O+2CO2
(3)CO一旦泄露会造成污染,环保检测中,有害气体的浓度常用1L有害气体的毫克值(mg/L)来表示,如对某气体样品中所含一氧化碳的浓度进行测定,其方法和实验步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL 5.00×10-3mol/L的硫代硫酸钠溶液恰好吸收所产生的碘,发生的反应为:
I2+2S2O32-═2I-+S4O62-,则样品中CO的浓度为5.25 mg/L.
分析 (1)①根据燃烧热的概念以及盖斯定律来计算化学反应的焓变;
②依据原料的利用率和对环境的影响分析判断;
(2)①化学反应达到平衡的标志是正逆反应速率相同,个组分含量保持不变,及其衍生出的各种物理量不变分析判断;
②甲烷和水经催化重整生成CO和H2,反应中C元素化合价有-4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32-,以此解答该题;
(3)根据关系式2Na2S2O3~I2,计算硫代硫酸钠溶液吸收所产生的碘后剩余的Na2S2O3物质的量,进而计算CO还原出的I2消耗Na2S2O3的物质的量,再根据关系式:2Na2S2O3~I2~5CO,计算CO的物质的量,据此计算CO的浓度.
解答 解:(1)①由H2(g)的燃烧热△H为-285.8kJ•mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,
即a、H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
b、CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
c、CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,
由盖斯定律可知,a×2+b-c得:CO (g)+2H2(g)═CH3OH (l)△H=-128.1kJ/mol,
故答案为:CO (g)+2H2(g)═CH3OH (l)△H=-128.1kJ/mol;
②煤进行气化和液化的优点是原料全部被产品消纳(或原料全部转化为产品,或原子利用率100%等),实现“零排放”或不对环境造成污染等,
故答案为:利用率高,污染小;
(2)①天然气催化重整也可生成CO和H2,500℃,向一体积可变的密闭容器中充入一定量CH4和水蒸气进行催化重整,反应的化学方程式为CH4+H2O=CO+3H2,是气体体积增大的反应,
A.体积可变的密闭容器,气体质量不变,体积若不变化,则混合气体的密度不随时间变化 说明反应达到平衡状态,故A正确;
B.CO和H2的体积分数之比不随时间变化一氧化碳和氢气生成物质的量之比始终相同,不能说明反应达到平衡状态,故B错误;
C.反应速率之比等于化学方程式计量数之比,为正反应速率之比,当3V正(CH4)=v逆(H2)时反应达到平衡状态,所以V正(CH4)=3v逆(H2)不能说明反应达到平衡状态,故C错误;
D.反应前后气体质量不变,气体物质的量变化,若混合气体的平均相对分子质量不随时间变化,说明反应达到平衡状态,故D正确;
故答案为:AD;
②电解质没有OH-,负极反应为:H2+CO32--2e-=H2O+CO2 ,CO-2e-+CO32-=2CO2,或H2+2CO+CO32--2e-=H2O+2CO2,
故答案为:H2+CO32--2e-=H2O+CO2,CO-2e-+CO32-=2CO2,或H2+2CO+CO32--2e-=H2O+2CO2;
(3)CO与I2O5反应生成CO2和I2,碳元素化合价由+2价升高为+4价,共升高2价,碘元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为10,故CO系数为5,I2O5系数为1.由原子守恒可知CO2系数为5,I2系数为1,反应方程式为5CO+I2O5=5CO2+I2.
关系式:2Na2S2O3~I2~5CO
2mol 5mol
0.030.0L×5.00×10-3mol/L y
解得:y=3.75×10-4mol
CO的浓度为$\frac{3.75×1{0}^{-4}mol×28g/mol}{2L}$=5.25×10-3g/L=5.25mg/L.
故答案为:5.25 mg/L;
点评 本题考查热化学方程式书写,化学平衡状态分析判断方法,原电池原理的理解应用,氧化还原反应的滴定计算等,难度中等,对于多步反应计算通常利用关系式解答,理解关系式并熟练运用.

 名校课堂系列答案
名校课堂系列答案| A. | 新制氢氧化铜 | B. | NaOH溶液 | C. | 金属钠 | D. | 银氨溶液 |
| A. | CH3CH(NO2)COOH分子中含有“手性碳原子” | |
| B. | HS-和HC1均是含一个极性键的18电子粒子 | |
| C. | 当用带有静电的玻璃棒接近CH2Cl2和CC14液体细流时,细流都不发生偏转 | |
| D. | 1mol己烷含有的共价键数目为19NA(NA代表阿伏加德罗常数) |
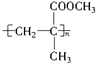 关于它的叙述不正确的是( )
关于它的叙述不正确的是( )| A. | 该有机玻璃的化学名称为聚甲基丙烯酸甲酯 | |
| B. | 该有机玻璃可用2-甲基丙烯酸和甲醇为原料,通过酯化反应、加聚反应制得 | |
| C. | 它在一定条件下发生水解反应时,可得到另外一种高分子化合物 | |
| D. | 等物质的量的有机玻璃和2-甲基丙烯酸甲酯耗氧量相同 |
| 实验事实 | 结论 | |
| A | 铁与硫单质生成FeS,与Cl2生成FeCl3 | 氧化性:Cl2>S |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊(H2SiO3) | 酸性:H2CO3>H2SiO3 |
| C | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| D | 某无色溶液加入盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液一定有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
| A. | As2O3中As元素为+3价 | B. | 维生素C能将+5价砷还原成As2O3 | ||
| C. | 致人中毒过程中砷发生氧化反应 | D. | 维生素C具有氧化性 |
| A. | 金属性:Na>Mg>Al | B. | 原子半径:Cl>Si>O | ||
| C. | 熔点:SiO2>NaCl>SO2 | D. | 酸性:HClO4>H2SO4>H2CO3 |
| A. | ⅤB族 | B. | ⅢB族 | C. | Ⅷ族 | D. | ⅤA族 |