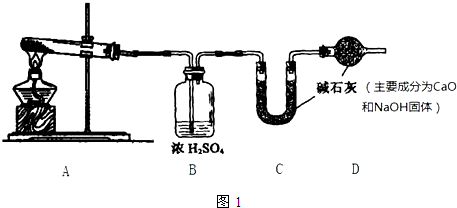
题目内容
3.A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:| 元素 | 元素性质或结构 |
| A | 最外层电子数是其内层电子数的2倍 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(2)B最简单气态氢化物的电子式
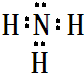 ,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式
,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式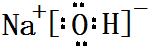 ,所含化学键类型:离子键、共价键.
,所含化学键类型:离子键、共价键.(3)B、C、D、E简单离子半径由大到小顺序为:S2->N3->O2->Na+(填元素符号).
(4)用电子式表示E的氢化物的形成过程
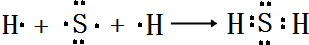 .
.(5)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O.
(6)19.2g金属铜与一定浓度的B的最高价氧化物的水化物反应,产生标准状况下NO、NO2(不考虑N2O4的存在)混合气6.72L,则参加反应的HNO3的物质的量为0.9mol.
分析 A、B、C、D、E均为短周期元素,且原子序数依次增大,A最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则A为碳元素;B元素的单质在空气中含量最多,则B为N元素;C元素在地壳中含量最多,则C为O元素;D元素在同周期中金属性最强,原子序数大于氧,处于第三周期IA族,故D为Na;常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积,则E为S元素,据此解答.
解答 解:A、B、C、D、E均为短周期元素,且原子序数依次增大,A最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则A为碳元素;B元素的单质在空气中含量最多,则B为N元素;C元素在地壳中含量最多,则C为O元素;D元素在同周期中金属性最强,原子序数大于氧,处于第三周期IA族,故D为Na;常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积,则E为S元素.
(1)E为硫元素,在元素周期表中的位置:第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
(2)B的最简单气态氢化物为NH3,电子式为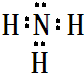 ,属于共价化合物,D的最高价氧化物对应水化物为NaOH,电子式为
,属于共价化合物,D的最高价氧化物对应水化物为NaOH,电子式为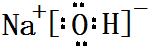 ,含有离子键、共价键,
,含有离子键、共价键,
故答案为: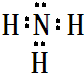 ;共价;
;共价;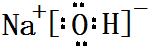 ;离子键、共价键;
;离子键、共价键;
NH3分子间能形成氢键;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->N3->O2->Na+,
故答案为:S2-;N3-;O2-;Na+;
(4)E的氢化物为H2S,用电子式表示形成过程为: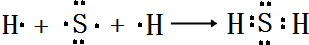 ,
,
故答案为: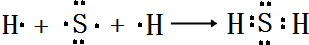 ;
;
(5)由C、N、O与H元素组成的一种常见的酸式盐为NH4HCO3,D的最高价氧化物对应的水化物为NaOH,碳酸氢铵与过量的NaOH反应的离子方程式为:NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O;
故答案为:NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O;
(6)19.2gCu的物质的量为$\frac{19.2g}{64g/mol}$=0.3mol,则n[Cu(NO3)2]=n(Cu)=0.3mol,n(NO、NO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,由N原子守恒可知,参加反应的HNO3的物质的量=2n[Cu(NO3)2]+n(NO、NO2)=0.9mol,
故答案为:0.9mol.
点评 本题考查位置结构性质关系综合应用,涉及电子式、微粒半径比较、离子方程式、化学计算等,推断元素是解题关键,是对学生综合能力的考查,(6)中注意守恒法的运用.

 阅读快车系列答案
阅读快车系列答案| A. | c(CH3COOH)>c(Na+) | B. | c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COOH)=c(CH3COO-)+c(H+) |
| A. | Mg | B. | Zn2+ | C. | Fe2+ | D. | H2 |
| A. | 稀HNO3 | B. | CuSO4溶液 | C. | FeCl3溶液 | D. | AgNO3溶液 |
| A. | 类铅元素原子的最外层电子数为7 | B. | 其常见价态为+2、+4、+6 | ||
| C. | 它的金属性比铅强 | D. | 它的原子半径比铅小 |
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | CO2+Ca(OH)2═CaCO3↓+H2O | ||
| C. | 2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$ 2H2O+O2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
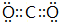 ,B与D形成的原子个数比为1:1的化合物的电子式是
,B与D形成的原子个数比为1:1的化合物的电子式是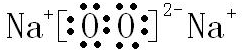 .
.