题目内容
13.下列反应中,不属于四种基本反应类型,也不属于氧化还原反应的是( )| A. | 2Na+2H2O═2NaOH+H2↑ | B. | CO2+Ca(OH)2═CaCO3↓+H2O | ||
| C. | 2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$ 2H2O+O2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
分析 不属于氧化还原反应,说明该反应中没有电子转移,其特征是没有元素化合价升降,不属于四种反应类型,说明不具有四种反应类型特点,据此分析解答.
解答 解:A、钠与水反应,存在化合价的变化,属于氧化还原反应,且属于置换反应,故A错误;
B、没有化合价的变化,也不属于四大基本反应类型,故B正确;
C、双氧水分解属于氧化还原反应,也属于分解反应,故C错误;
D、没有化合价的变化,但是属于复分解反应,故D错误,
故选B.
点评 本题考查了氧化还原反应及四大反应类型,明确氧化还原反应的实质及四大反应类型特点是解本题关键,根据元素化合价变化及四大反应类型特点判断即可,题目难度不大.

练习册系列答案
相关题目
3.A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
(1)E在元素周期表中的位置第三周期第ⅥA族.
(2)B最简单气态氢化物的电子式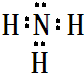 ,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式
,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式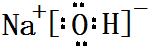 ,所含化学键类型:离子键、共价键.
,所含化学键类型:离子键、共价键.
(3)B、C、D、E简单离子半径由大到小顺序为:S2->N3->O2->Na+(填元素符号).
(4)用电子式表示E的氢化物的形成过程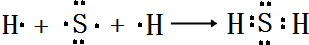 .
.
(5)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O.
(6)19.2g金属铜与一定浓度的B的最高价氧化物的水化物反应,产生标准状况下NO、NO2(不考虑N2O4的存在)混合气6.72L,则参加反应的HNO3的物质的量为0.9mol.
| 元素 | 元素性质或结构 |
| A | 最外层电子数是其内层电子数的2倍 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(2)B最简单气态氢化物的电子式
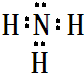 ,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式
,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式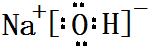 ,所含化学键类型:离子键、共价键.
,所含化学键类型:离子键、共价键.(3)B、C、D、E简单离子半径由大到小顺序为:S2->N3->O2->Na+(填元素符号).
(4)用电子式表示E的氢化物的形成过程
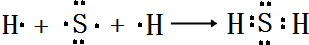 .
.(5)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O.
(6)19.2g金属铜与一定浓度的B的最高价氧化物的水化物反应,产生标准状况下NO、NO2(不考虑N2O4的存在)混合气6.72L,则参加反应的HNO3的物质的量为0.9mol.
1.下列实验装置能达到相应实验目的是( )
| A. | 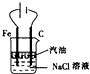 用如图装置制取Fe(OH)2沉淀 | |
| B. | 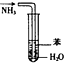 用如图装置吸收NH3,并防止倒吸 | |
| C. | 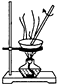 用如图装置蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 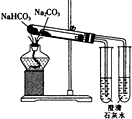 用如图装置比较Na2CO2与NaHCO3的稳定性 |
8.某工业生产经过以下转化步骤:
下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 该过程是一种新的硫酸生产方法 | |
| B. | C2H5OSO3H具有酸性 | |
| C. | 该过程中①、②是加成反应 | |
| D. | 该过程中③、④可看做酯类的水解反应 |
18.下列离子方程式书写正确的是( )
| A. | Cl2和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Fe加入CuSO4溶液:2Fe+3Cu2+═2Fe3++3Cu | |
| C. | AlCl3溶液中加入氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++H2O+CO2↑ |
5.下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
| A. | CO2 通入澄清石灰水中 | B. | Na2CO3溶液和HCl溶液反应 | ||
| C. | AlCl3溶液的NaOH 溶液反应 | D. | 铁丝在氯气中燃烧 |
2.具有下列电子层结构的基态原子或离子,其对应元素一定属于同一周期的是( )
| A. | 两种原子的电子层上全部都是s电子 | |
| B. | 原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子 | |
| C. | 最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子 | |
| D. | 3p能级上只有一个空轨道的原子和3p能级上有一个未成对电子的原子 |
3.在空气吹出法的工艺中,有选用纯碱溶液作溴蒸气吸收剂的,也有选用SO2作溴蒸气吸收剂的,下列有关说法正确的是( )
| A. | 两种吸收过程中,Br2只作氧化剂 | |
| B. | 两种吸收过程都发生了氧化还原反应 | |
| C. | 用纯碱溶液作吸收剂时,纯碱作还原剂 | |
| D. | 用纯碱溶液作吸收剂只发生了复分解反应 |
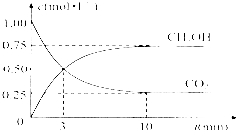 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.