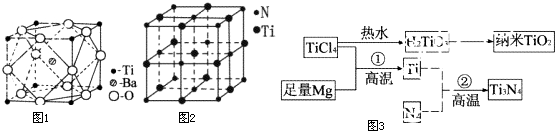
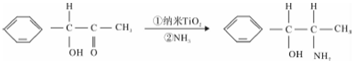
题目内容
8.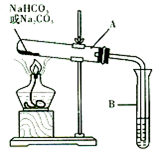 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.
(1)提出假设:Na2C03或NaHC03加热分解时可能有C02生成.
(2)设计实验:①利用如图装置分别对一定量的Na?C03和 NaHCOa进行加热;②为了检验CO2的生成,试管B中应加人的物质是澄清石灰水(填“澄清的石灰水”或“NaOH 溶液”).
(3)现象与结论:同学们发现只有在加热NaHCO3时,试管B中才有气泡产生且有白色沉淀生成(填沉淀的颜色),说明NaC03和NaHCO3的热稳定性是Na2CO3>NaHC03(填“>”或“<”);由此得出结论:除去Na3C03固体中混有的NaHC03杂质的方法是加热.
(4)某同学在探究NaHCO3的热稳定性时,称取了 8.4g NaHCO3,充分加热,请你计算理论上可产生C02气体的体积为1.12L(标准状况).
分析 (2)检验二氧化碳的常用试剂为澄清石灰水,二氧化碳与氢氧化钠溶液的反应没有明显现象;
(3)碳酸氢钠分解生成的二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀;证明碳酸钠比碳酸氢钠稳定,可以据此通过加热方法除去碳酸钠中混有的碳酸氢钠;
(4)根据反应关系式计算出生成的二氧化碳气体在标况下的体积.
解答 解:(2)由于氢氧化钠溶液与二氧化碳的反应没有明显现象,所以无法检验是否有二氧化碳生成,检验二氧化碳气体的常用试剂为澄清石灰水,将二氧化碳气体通入澄清石灰水,澄清石灰水会变浑浊,
故答案为:澄清石灰水;
(3)碳酸钠加热不分解,而碳酸氢钠加热分解生成二氧化碳气体,二氧化碳通入澄清石灰水后,溶液变浑浊,生成了白色沉淀碳酸钙,说明碳酸钠稳定性大于碳酸氢钠,所以除去Na3C03固体中混有的NaHC03杂质,可以通过加热的方法完成,
故答案为:白色;>;加热;
(4)碳酸氢钠分解的关系式为:2NaHCO3~CO2,8.4gNaHCO3的物质的量为0.1mol,完全分解可以生成0.05mol二氧化碳,标况下0.05mol二氧化碳的体积为:22.4L/mol×0.05mol=1.12L,
故答案为:1.12.
点评 本题考查碳酸钠、碳酸氢钠的性质比较,为高频考点,题目难度中等,把握碳酸钠、碳酸氢钠的热稳定性大小及发生的反应为解答的关键,试题侧重分析、实验及计算能力的考查.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
16.Na2C03俗名纯碱,下面有关纯碱分类的叙述中不正确的是( )
| A. | Na2CO3 是碱 | B. | Na2C03 是盐 | C. | Na2C03是钠盐 | D. | Na2CO3是碳酸盐 |
3.下列各组混合物,可以用分液漏斗分离的是( )
| A. | 四氯化碳和溴 | B. | 乙醇和水 | C. | 苯和汽油 | D. | 乙酸乙酯和水 |
13.室温下,下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | pH=a的H2S溶液中,c(H+)=c(HS-)=1×10-amol.L-1 | |
| B. | 等物质的量的Na2CO3和NaHCO3混合液:c(HCO3)>c(CO32-) | |
| C. | H2C204 与 NaOH 溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c( HC204-) | |
| D. | (NH4)2SO4 溶液中:c(SO42-)=2c(NH4+)+2c(NH3•H20) |
20.六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E 同主族,B与F 同主族,E与F同周期.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
| A. | A、C两种元素可组成化学式为C2A4的化合物 | |
| B. | E氧化物的水化物有两性 | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
18.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 18g 18O2 中含有NA个氧原子 | |
| B. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA |