题目内容
3.下列各组混合物,可以用分液漏斗分离的是( )| A. | 四氯化碳和溴 | B. | 乙醇和水 | C. | 苯和汽油 | D. | 乙酸乙酯和水 |
分析 根据分液漏斗可以将互不相溶的两层液体分开,分析选项中物质的溶解性即可.
解答 解:A、四氯化碳和溴互溶,不能用分液漏斗进行分离,故A错误;
B、水和乙醇以任意比例互溶,不能用分液漏斗进行分离,故B错误;
C、苯和汽油互溶,不能用分液漏斗进行分离,故C错误;
D、乙酸乙酯和水不溶,能用分液漏斗进行分离,故D正确;故选D.
点评 本题考查了物质分离方法中的分液法,熟记物质的溶解性是解题的关键所在,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列各离子组在溶液中能大量共存且通入括号中相应气体后,仍能大量共存的是( )
| A. | NH4+、Ca2+、HSO3-、Cl- (氨气) | B. | Ba2+、NO3-、Na+、Cl- (二氧化硫) | ||
| C. | Na+、K+、HCO3-、Cl- (二氧化碳) | D. | Al3+、SO42-、HCO3-、NO3- (氯化氢) |
18.实验室常用于保存钠的液体是( )
| A. | 煤油 | B. | 水. | C. | 汽油 | D. | 四氯化碳 |
15.如图是常温下部分短周期元素,最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,其中H的氧化物是两性氧化物.下列说法正确的是( )
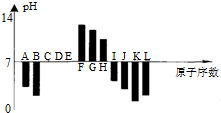

| A. | 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大. | |
| B. | 根据图形分析可知,K,L两种元素最高价氧化物对应的水化物的酸性,前者较强. | |
| C. | 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同. | |
| D. | 元素K、H、G分别形成的简单离子的半径逐渐减少 |
 金属作为一种能源受到越来越多的关注.
金属作为一种能源受到越来越多的关注.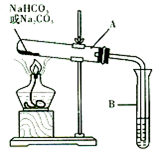 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计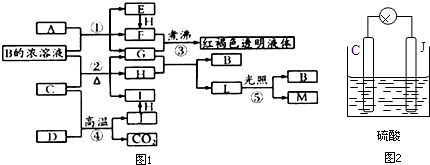
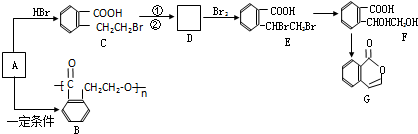
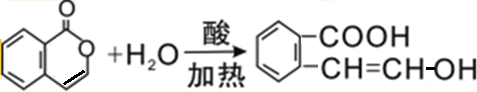
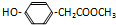 .
.