题目内容
13.室温下,下列溶液中粒子的物质的量浓度关系正确的是( )| A. | pH=a的H2S溶液中,c(H+)=c(HS-)=1×10-amol.L-1 | |
| B. | 等物质的量的Na2CO3和NaHCO3混合液:c(HCO3)>c(CO32-) | |
| C. | H2C204 与 NaOH 溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c( HC204-) | |
| D. | (NH4)2SO4 溶液中:c(SO42-)=2c(NH4+)+2c(NH3•H20) |
分析 A、硫化氢是二元弱酸,分两步电离,所以c(H+)=1×10-amol.L-1>c(HS-);
B、碳酸钠的水解程度大于碳酸氢钠的水解程度;
C、根据电荷守恒分析解答;
D、根据物料守恒分析解答.
解答 解:A、硫化氢是二元弱酸,分两步电离,所以c(H+)=1×10-amol.L-1>c(HS-),故A错误;
B、碳酸钠的水解程度大于碳酸氢钠的水解程度,所以c(HCO3)>c(CO32-),故B正确;
C、由电荷守恒,可知:c(Na+)+c(H+)=c(OH-)+c( HC204-)+2c( C2042-),故C错误;
D、铵根离子是弱离子,在溶液中存在两种形式,根据物料守恒:2c(SO42-)=c(NH4+)+c(NH3•H20),故D错误;
故选B.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,学会利用电荷守恒、物料守恒、盐的水解原理结合溶液中的电离平衡问题解决离子浓度大小的问题.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
3.25℃下,几种酸的电离平衡常数如表所示,则相关说法不正确的是( )
| 酸 | 醋酸 | 次氯酸 | 亚硝酸 |
| 电离常数 | 1.7×10-5 | 3.0×10-8 | 7.1×10-4 |
| A. | pH相同的氯水和亚硝酸溶液中水电离的c(H+)相同 | |
| B. | 向氯水中滴加氢氧化钠溶液至中性:c(Na+)=2 c(ClO-)+c(HClO) | |
| C. | 向漂白粉溶液中滴加H2SO3溶液可增强其漂白能力 | |
| D. | pH相同的醋酸钠、次氯酸钠和亚硝酸钠溶液中,c(Na+)最大的是亚硝酸钠 |
1.下列物质中只含有共价键的是( )
| A. | H202 | B. | NaCl | C. | NH4CI | D. | AI2O3 |
18.下列说法不正确的是( )
| A. | 氢氧燃料电池要进入广泛的实际应用,高容量储氢材料的研制是需解决的关键技术问题之一 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 2013年6月航天员王亚平在太空做的水膜实验说明:水分子的组成和结构在太空中发生了改变,水才有不同于其在地球上的物理现象 | |
| D. | 元素分析仪可检验C、H、O、N、S等非金属元素,也可以检验Cr、Mn等金属元素 |
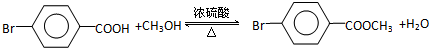
2.某药物中间体的合成路线如下.下列说法正确的是( )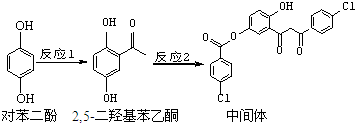

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
 己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题:
己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题: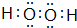 .
.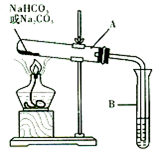 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.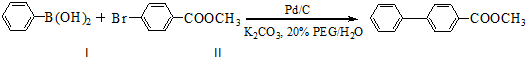

 .
. ,
,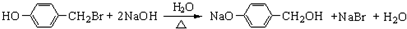
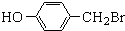
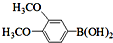 与化合物
与化合物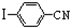 在一定条件可发生类似反应①的反应,其产物的结构简式为
在一定条件可发生类似反应①的反应,其产物的结构简式为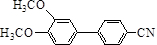 .
.