题目内容
19.钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题: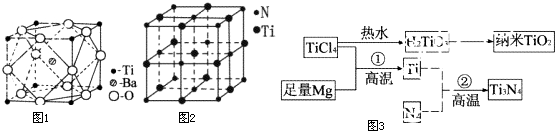
(1)钛有${\;}_{22}^{48}Ti$和${\;}_{22}^{50}Ti$两种原子,它们互称为同位素,元素在元素周期表中的位置是第四周期第IVB族;基态原子的电子排布式为1s22s22p63S23p63d24s2(或[Ar]3d24s2);按电子排布Ti元素在元素周期表分区中属于d区元素.
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如图1所示,它的化学式是BaTiO3.
(3)氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金代替品.以TiCl4为原料,经过一系列反应,如图3,可以制得Ti3N4和纳米TiO2.
①Ti3N4中Ti元素的化合价为+4,TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为四面体.
②反应①为置换反应,写出该反应的化学方程式2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2;
③纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下:
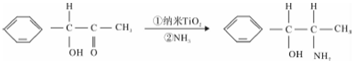
化合物甲的分子中采取sp2杂化的碳原子个数为7,化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为N>O>C.
④有一种氮化钛晶体的晶胞如图2所示,该氮化钛晶胞中含有4个N原子,晶胞中N、Ti之间的最近距离为apm,则该氮化钛的密度为$\frac{62×2}{(2a×1{0}^{-10})^{3}.{N}_{A}}$ g/cm3.
(4)现有含Ti3+的配合物,化学式为TiCl3(H2O)6,将1mol该物质溶于水,加入足量硝酸银溶液,产生沉淀的氯化银为1mol,已知该配合物的配位数为6,则该配离子的结构简式为[TiCl2(H2O)4]+,配离子所含有的化学键类型是极性键,该配合物的配位体是H2O、Cl-.
分析 (1)质子数相同、中子数不同的同一元素不同原子互称同位素;Ti位于第四周期第IVB族;其原子核外有22个电子,根据构造原理书写其基态原子核外电子排布式;根据原子最后排入电子名称确定元素所属区;
(2)该化合物中,O原子个数=12×$\frac{1}{4}$=3,Ti原子个数=8×$\frac{1}{8}$=1,Ba原子个数为1;
(3)①根据化合物中化合价的代数和为0计算Ti元素的化合价,TiCl4分子中4个氯原子不在同一平面上,说明TiCl4分子结构和甲烷相同;
②根据反应物、生成物和反应条件书写方程式;
③采取sp2杂化的碳原子价层电子对数是3,根据价层电子对数判断;采取sp3杂化的原子价层电子对数是4,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于相邻元素;
④利用均摊法计算N原子个数,根据ρ=$\frac{m}{V}$计算密度;
(4)现有含Ti3+的配合物,化学式为TiCl3(H2O)6,将1mol该物质溶于水,加入足量硝酸银溶液,立即沉淀的氯化银为1mol,该配合物的配位数为6,说明该配合物中配体有两个Cl-、4个水分子,据此书写该配离子的结构简式,配离子所含有的化学键类型是极性键,该配合物的配位体是水和氯离子.
解答 解:(1)2248Ti和2250Ti为质子数相同中子数不同的钛元素的不同原子,互称同位素;Ti元素核外有22个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63S23p63d24s2(或[Ar]3d24s2),该元素的能层数为4、价电子数为4,所以钛元素位于第四周期第IVB族,钛元素最后排列电子是d电子,所以钛元素属于d区,
故答案为:同位素;1s22s22p63S23p63d24s2(或[Ar]3d24s2);四;IVB;d;
(2)该化合物中,O原子个数=12×$\frac{1}{4}$=3,Ti原子个数=8×$\frac{1}{8}$=1,Ba原子个数为1,所以其化学式为:BaTiO3,故答案为:BaTiO3;
(3)①该化合物中氮元素化合价为-3价,根据化合价代数和为0知,Ti元素化合价为+4价,TiCl4分子中4个氯原子不在同一平面上,说明TiCl4分子结构和甲烷相同,为正四面体结构,故答案为:+4;正四面体;
②根据反应物、生成物和反应条件知,该反应方程式为:2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2,故答案为:2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2;
③采取sp2杂化的碳原子价层电子对数是3,该分子中碳原子价层电子对数为3的有:苯环上的碳原子、连接羰基的碳原子,所以一共有7个;采取sp3杂化的原子价层电子对数是4,价层电子对个数是4的原子有:连接甲基和羟基的碳原子、氧原子和氮原子,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于相邻元素,所以这三种元素第一电离能从大到小顺序是:N>O>C,
故答案为:7;N>O>C;
④该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Ti原子个数=1+12×$\frac{1}{4}$=4,该晶胞的ρ=$\frac{m}{V}$=$\frac{\frac{62}{{N}_{A}}×4}{(2a×1{0}^{-10})^{3}}$g.cm-3=$\frac{62×2}{(2a×1{0}^{-10})^{3}.{N}_{A}}$g.cm-3,
故答案为:4;$\frac{62×2}{(2a×1{0}^{-10})^{3}.{N}_{A}}$;
(4)现有含Ti3+的配合物,化学式为TiCl3(H2O)6,将1mol该物质溶于水,加入足量硝酸银溶液,立即沉淀的氯化银为1mol,该配合物的配位数为6,说明该配合物中配体有两个Cl-、4个水分子,该配离子的结构简式[TiCl2(H2O)4]+,配离子所含有的化学键类型是极性键,该配合物的配位体是水和氯离子,故答案为:[TiCl2(H2O)4]+;极性键;H2O、Cl-.
点评 本题考查物质结构和性质,涉及晶胞计算、配合物、原子杂化、原子核外电子排布等知识点,这些都是高频考点,难点是(3)题晶胞计算、(4)题配合物,知道配合物中內界和外界区别.

 期末集结号系列答案
期末集结号系列答案①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀,且白色沉淀逐渐增多后又部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;
③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰,
下列推断正确的( )
| A. | 由①只能确定溶液中有Al3+、Mg2+,没有HCO3- | |
| B. | 由②知溶液中有SO42-,没有Ba2+ | |
| C. | 由③确定溶液中有Na+,没有K+ | |
| D. | 若检验溶液中是否有存在Cl-,可取少许原溶液,直接向其中加入AgNO3溶液 |
| A. | NH4+、Ca2+、HSO3-、Cl- (氨气) | B. | Ba2+、NO3-、Na+、Cl- (二氧化硫) | ||
| C. | Na+、K+、HCO3-、Cl- (二氧化碳) | D. | Al3+、SO42-、HCO3-、NO3- (氯化氢) |
| A. | 以焦炭和二氧化硅为原料生产单质硅 | |
| B. | 以氨气为原料生产硝酸 | |
| C. | 电解氯化镁溶液生产金属镁 | |
| D. | 电解熔融氯化钠生产金属钠 |

 +2H2O.
+2H2O. 己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题:
己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题: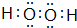 .
.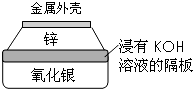 金属作为一种能源受到越来越多的关注.
金属作为一种能源受到越来越多的关注.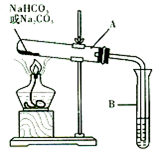 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计