题目内容
17.碳及其化合物在工农业生产生活中有着重要作用.请按要求回答下列问题:
(1)已知:C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1;
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
将水蒸气喷到灼热的炭上可实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g),△H=+132kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为2L的恒容密闭容器中,一定条件下发生反应为CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组实验数
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.4mol/(L•min).若在此温度下H2O(g)、CO(g)起始量分别为2mol、4mol,则此反应的平衡常数为$\frac{8}{3}$.
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图1坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作标注实验编号.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池的负极反应式为CH3OH-6e-+8OH-═CO32-+6H2O.
(4)一定条件下,如图2示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为
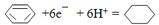 .
.
分析 (1)已知①C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;
③2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1;
根据盖斯定律,①-$\frac{1}{2}$(②+③)得C(s)+H2O(g)=CO(g)+H2(g),△H;
(2)①假定平衡不发生移动,实验2条件下平衡时CO2的物质的量应为$\frac{1}{2}×3.2$mol=1.6mol,实际为0.8mol,说明温度升高,平衡逆向移动;
②v(CO2)=$\frac{3.2mol}{2L×4min}$=0.4mol/(L•min),根据化学反应速率之比等于化学计量数之比计算v(H2)表示的反应速率;化学平衡常数只与温度有关,与反应物的起始浓度无关,利用表中实验1的数据,结合三段法计算平衡时各组分的平衡浓度,带入化学平衡常数表达式计算;
③实验2中平衡时生成0.8molCO2,同时会消耗0.8mol的CO,因此实验2达到平衡时CO的转化率为$\frac{0.8mol}{4mol}$×100%;
④实验3相比于实验2,化学平衡没有影响,只是增大了化学反应速率,因此改变的条件为加入了催化剂,实验3达到平衡所用时间为1min,而实验2所用时间为3min,CO2的平衡浓度为0.4mol/L,结合表格数据画出c-t图;
(3)甲醇的电极为负极,甲醇失电子,甲醇燃烧生成 CO2,CO2在氢氧化钾溶液中以KCO3形式存在,因此负极电极式为CH3OH-6e-+8OH-═CO32-+6H2O;
(4)该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷.
解答 解:(1)已知①C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;
③2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1;
根据盖斯定律,①-$\frac{1}{2}$(②+③)得C(s)+H2O(g)=CO(g)+H2(g),△H=-393kJ•mol-1-$\frac{1}{2}$×(-566kJ•mol-1-484kJ•mol-1)=+132kJ•mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g),△H=+132kJ•mol-1;
(2)①假定平衡不发生移动,实验2条件下平衡时CO2的物质的量应为$\frac{1}{2}×3.2$mol=1.6mol,实际为0.8mol,说明温度升高,平衡逆向移动,则反应为放热反应,
故答案为:放热;
②v(CO2)=$\frac{3.2mol}{2L×4min}$=0.4mol/(L•min),$\frac{v({H}_{2})}{v(C{O}_{2})}$=$\frac{1}{1}$,因此v(H2)=0.4mol/(L•min),
化学平衡常数只与温度有关,与反应物的起始浓度无关,则
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):4 8 0 0
变化(mol):3.2 3.2 3.2 3.2
平衡(mol):0.8 4.8 3.2 3.2
平衡(mol/L):0.4 2.4 1.6 1.6
因此500℃时该反应的化学平衡常数K=$\frac{1.6×1.6}{0.4×2.4}$=$\frac{8}{3}$,
故答案为:0.4mol/(L•min);$\frac{8}{3}$;
③实验2中平衡时生成0.8molCO2,同时会消耗0.8mol的CO,因此实验2达到平衡时CO的转化率为$\frac{0.8mol}{4mol}$×100%=20%,
故答案为:20%;
④实验3相比于实验2,化学平衡没有影响,只是增大了化学反应速率,因此改变的条件为加入了催化剂,实验3达到平衡所用时间为1min,而实验2所用时间为3min,CO2的平衡浓度为0.4mol/L,结合表格数据画出c-t图如下: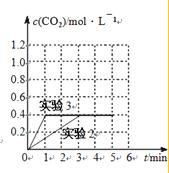 ,
,
故答案为:加催化剂; ;
;
(3)甲醇的电极为负极,甲醇失电子,甲醇燃烧生成 CO2,CO2在氢氧化钾溶液中以KCO3形式存在,因此负极电极式为CH3OH-6e-+8OH-═CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;
(4)该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,电解池阴极与电源负极相连,得出电解过程中产生的气体为O2,阴极上苯得电子和氢离子生成环己烷,电极反应式为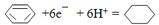 ,
,
故答案为: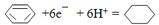 .
.
点评 本题考查较为综合,涉及热化学方程式的书写、化学反应速率和化学平衡、燃料电池和电解池原理,综合性强,为高考高频考点,具有很强的代表性,侧重于化学反应原理和计算能力的考查,难度较大.

| A. | 结构简式为 的有机物其名称为 2-丁醇 的有机物其名称为 2-丁醇 | |
| B. | 分子式为C4H8Br2结构中含一个一CH3的同分异构体(不考虑立体异构)有4种 | |
| C. | 某有机物球棍结构模型为: ,则该有机物能发生消去反应和氧化反应 ,则该有机物能发生消去反应和氧化反应 | |
| D. | 二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
| A. | 晶体中105B和115B两种同位素原子的质量比为1:4 | |
| B. | 5.4 g该晶体硼所含中子为2.9 mol | |
| C. | 等质量的分别由105B和115B构成的晶体硼所含中子数之比为6:5 | |
| D. | 若碳原子质量为w g,则105B原子的质量为10w g |
| A. | 原混合溶液中c(K+)为4 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
| A. | 2:1:2 | B. | 5:5:4 | C. | 1:1:1 | D. | 无法确定 |
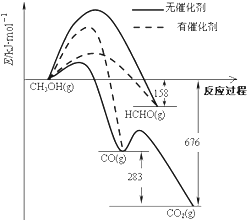 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )| A. | 未使用催化剂,氧化产物有三种 | |
| B. | 使用催化剂,氧化产物主要是CO或者HCHO | |
| C. | CH3OH的燃烧热大于676kJ•mol-1 | |
| D. | 2HCHO(g)+O2=2CO(g)+2H2O(g)△H=-470kJ•mol-1 |
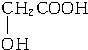 .
.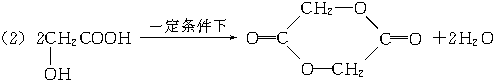 .
.