题目内容
9.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )| A. | 原混合溶液中c(K+)为4 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
分析 电解硝酸钾和硝酸铜混合溶液时,阳极上氢氧根离子放电生成氧气,阴极上先铜离子放电生成铜单质,当铜离子完全析出时,氢离子放电生成氢气,根据得失电子守恒计算铜的物质的量,再结合电荷守恒计算钾离子的浓度,据此分析解答.
解答 解:电解硝酸钾和硝酸铜混合溶液时,阳极上氢氧根离子放电生成氧气,阴极上先铜离子放电生成铜单质,当铜离子完全析出时,氢离子放电生成氢气,气体的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol;
每生成1mol氧气转移4mol电子,每生成1mol氢气转移2mol电子,每生成1mol铜转移2mol电子,
所以根据转移电子守恒得铜的物质的量=$\frac{1mol×4-1mol×2}{2}$=1mol,
则铜离子的物质的量浓度=$\frac{1mol}{0.5L}$=2mol/L,
根据电荷守恒得钾离子浓度=6mol•L-1-2mol/L×2=2mol/L,
A.根据分析知,原混合溶液中c(K+)为2 mol•L-1,故A错误;
B.转移电子的物质的量=1mol×4=4mol,故B正确;
C.根据以上分析知,铜的物质的量为1mol,故C错误;
D.当电解硝酸铜时溶液中生成氢离子,当电解硝酸钾溶液时,实际上是电解水,所以电解后氢离子的物质的量为氧气的4倍,为1mol×4=4mol,则氢离子浓度=$\frac{4mol}{0.5L}$=8mol/L,故D错误;
故选:B.
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,结合转移电子守恒、电荷守恒来分析解答,难度中等.

练习册系列答案
相关题目
19.某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿氏常数,下列说法中正确的是( )
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该原子质量为aNAg | ||
| C. | x g该氧原子所含的电子数为$\frac{8x}{a}$ | D. | y g 该氧原子的中子数一定为$\frac{8y}{a}$ |
17.碳及其化合物在工农业生产生活中有着重要作用.请按要求回答下列问题:

(1)已知:C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1;
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
将水蒸气喷到灼热的炭上可实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g),△H=+132kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为2L的恒容密闭容器中,一定条件下发生反应为CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组实验数
①该反应的正反应为放热(填“吸热”或“放热”)反应.
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.4mol/(L•min).若在此温度下H2O(g)、CO(g)起始量分别为2mol、4mol,则此反应的平衡常数为$\frac{8}{3}$.
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图1坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作标注实验编号.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池的负极反应式为CH3OH-6e-+8OH-═CO32-+6H2O.
(4)一定条件下,如图2示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为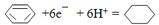 .
.

(1)已知:C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1;
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
将水蒸气喷到灼热的炭上可实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g),△H=+132kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为2L的恒容密闭容器中,一定条件下发生反应为CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组实验数
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.4mol/(L•min).若在此温度下H2O(g)、CO(g)起始量分别为2mol、4mol,则此反应的平衡常数为$\frac{8}{3}$.
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图1坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作标注实验编号.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池的负极反应式为CH3OH-6e-+8OH-═CO32-+6H2O.
(4)一定条件下,如图2示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为
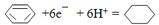 .
.
1.在空气中直接蒸发下列盐的溶液:①Al2(SO4)3;②Na2CO3;③KCl;④CuCl2;⑤NaHCO3,可以得到相应盐的晶体(可以含有结晶水)的是( )
| A. | ①③⑤ | B. | ①②③ | C. | ②④ | D. | ①③④⑤ |
18.下列关于苯酚的叙述中,错误的是( )
| A. | 其水溶液显酸性,俗称石碳酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |
19.锌-空气电池是一种新型的高校电池,其荷电量一般比同体积的锌锰电池大3倍以上.在碱性环境下,其总反应方程式为2Zn+2NaOH+O2=2NaHZnO2.下列说法正确的是( )
| A. | 该电池的负极反应方程式为Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 当负极减重65g时,正极消耗O2的体积为11.2L | |
| C. | 电池在放电过程中阳离子移向负极,阴离子移向正极 | |
| D. | 随着放电过程进行,电池正极区域附近pH减小 |
 .
. .常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.
.常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.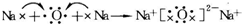 .
. 6
6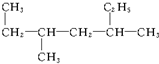 7
7 6
6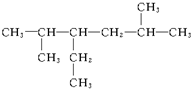 6.
6.