题目内容
7.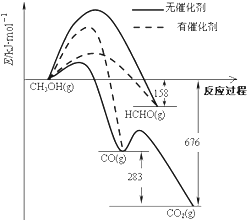 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )| A. | 未使用催化剂,氧化产物有三种 | |
| B. | 使用催化剂,氧化产物主要是CO或者HCHO | |
| C. | CH3OH的燃烧热大于676kJ•mol-1 | |
| D. | 2HCHO(g)+O2=2CO(g)+2H2O(g)△H=-470kJ•mol-1 |
分析 A.未使用催化剂时,CH3OH与O2反应产物有HCHO、CO、CO2;
B.使用催化剂时,CH3OH与O2反应产物有CO或者HCHO;
C.由图可知1mol甲醇蒸汽完全燃烧放出的热量为676kJ;
D.根据图表可知2HCHO(g)+O2(g)═2CO(g)+2H2O(g)中反应物能量高,生成物能量低,该反应为放热反应,然后依据图中给出数据解答.
解答 解:A.未使用催化剂时,CH3OH与O2发生反应时,氧化产物有HCHO、CO、CO2,则氧化产物有三种,故A正确;
B.使用催化剂时,氧化产物主要是CO或者HCHO,故B正确;
C.由图可知1mol甲醇蒸汽完全燃烧放出的热量为676kJ,由于常温下甲醇为液体,而液态时能量低于气态,则1mol液态甲醇完全燃烧放出的热量小于676kJ,所以CH3OH的燃烧热小于676kJ•mol-1,故C错误;
D.2HCHO(g)+O2(g)═2CO(g)+2H2O(g)该反应为放热反应,△H=-2(676-158-283)KJ•mol-1=-470KJ•mol-1,则热化学方程式为:2HCHO(g)+O2=2CO(g)+2H2O(g)△H=-470kJ•mol-1,故D正确.
故选C.
点评 本题考查了化学反应中的能量变化,侧重于图象的分析和反应热的计算的考查,题目难度不大.

练习册系列答案
相关题目
17.碳及其化合物在工农业生产生活中有着重要作用.请按要求回答下列问题:

(1)已知:C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1;
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
将水蒸气喷到灼热的炭上可实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g),△H=+132kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为2L的恒容密闭容器中,一定条件下发生反应为CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组实验数
①该反应的正反应为放热(填“吸热”或“放热”)反应.
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.4mol/(L•min).若在此温度下H2O(g)、CO(g)起始量分别为2mol、4mol,则此反应的平衡常数为$\frac{8}{3}$.
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图1坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作标注实验编号.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池的负极反应式为CH3OH-6e-+8OH-═CO32-+6H2O.
(4)一定条件下,如图2示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为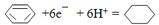 .
.

(1)已知:C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1;
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
将水蒸气喷到灼热的炭上可实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g),△H=+132kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为2L的恒容密闭容器中,一定条件下发生反应为CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组实验数
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.4mol/(L•min).若在此温度下H2O(g)、CO(g)起始量分别为2mol、4mol,则此反应的平衡常数为$\frac{8}{3}$.
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图1坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作标注实验编号.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池的负极反应式为CH3OH-6e-+8OH-═CO32-+6H2O.
(4)一定条件下,如图2示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为
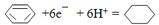 .
.
18.下列关于苯酚的叙述中,错误的是( )
| A. | 其水溶液显酸性,俗称石碳酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |
15.A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素的名称N、S、F;
(2)B位于元素周期表中第三周期,第ⅥA族;
(3)C的原子结构示意图为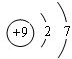 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
| A | C | |
| B |
(2)B位于元素周期表中第三周期,第ⅥA族;
(3)C的原子结构示意图为
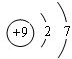 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
2.类推的思维方式在化学学习与研究中经常采用,但类推得出的结论是否正确最终要经过实践的验证.以下类推的结论正确的是( )
| A. | 由Cl2+H2O=HCl+HClO可推出F2+H2O=HF+HFO | |
| B. | HCl的水溶液是强酸,推出HF水溶液也是强酸 | |
| C. | 由2Fe+3Cl2=2FeCl3可推出2Fe+3I2=2FeI3 | |
| D. | Na、K在属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
12.在锌铜原电池中,当导线中有1mole-通过时,从理论上分析,两极的变化是( )
①锌片溶解了32.5g ②锌片增重了32.5g
③铜片上析出1g氢气 ④铜片上析出1mol氢气.
①锌片溶解了32.5g ②锌片增重了32.5g
③铜片上析出1g氢气 ④铜片上析出1mol氢气.
| A. | ①和③ | B. | ①和④ | C. | ②和③ | D. | ②和④ |
19.锌-空气电池是一种新型的高校电池,其荷电量一般比同体积的锌锰电池大3倍以上.在碱性环境下,其总反应方程式为2Zn+2NaOH+O2=2NaHZnO2.下列说法正确的是( )
| A. | 该电池的负极反应方程式为Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 当负极减重65g时,正极消耗O2的体积为11.2L | |
| C. | 电池在放电过程中阳离子移向负极,阴离子移向正极 | |
| D. | 随着放电过程进行,电池正极区域附近pH减小 |
16.下列物质不能用于萃取溴水中溴的是( )
| A. | 直馏汽油 | B. | 裂化汽油 | C. | 酒精 | D. | 己烷 |
1. 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )| A. | 实验开始时需给a试管稍微加热 | |
| B. | 反应开始时铜片表面可以看到有黑色物质生成 | |
| C. | 将a试管里的溶液冷却后注入盛有水的烧杯中,溶液呈蓝色 | |
| D. | b试管中的溶液逐渐褪为无色,说明反应生成的气体,将品红氧化为无色 |