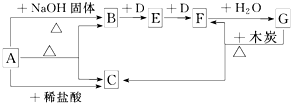
题目内容
7.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入下图装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极.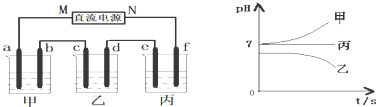
接通电源,经过一段时间后,测得乙中c电极质量增加.常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响).据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式2CuSO4+2H2O2Cu+O2↑+H2SO4;
(2)电极f上发生的电极反应为4OH--4e-=2H2O+O2↑;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是向丙烧杯中加入水2.25g.
分析 乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,根据电解池的工作原理结合电极反应式进行计算即可.
解答 解:乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,
(1)乙烧杯为电解硫酸铜溶液,反应的总反应式为2CuSO4+2H2O2Cu+O2↑+H2SO4,
故答案为:2CuSO4+2H2O2Cu+O2↑+H2SO4;
(2)丙为电解硫酸钠溶液,f为阳极,电极f上发生的电极反应为4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
(3)c电极质量增加了8g,为Cu,n(Cu)==0.125mol,转移0.25mol电子,
丙中发生2H2OO2↑+2H2↑,转移0.25mol电子应消耗0.125mol水,质量为0.125mol×18g/mol=2.25g,应加入2.25g水可恢复到原来的浓度,
故答案为:向丙烧杯中加入水2.25g.
点评 本题考查电解池的工作原理知识,注意电解中最关键的是准确判断出电极上离子的放电顺序,在判断电解产物时,首先判断阳极电极材料.如果是活性电极,则电极本身失去电子.如果是惰性电极,则溶液中的阴离子失去电子,而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
17.除去铝表面的铜镀层可选用的试剂是( )
| A. | 浓硝酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 浓硫酸 |
18.工业上制取氧气的主要方法是( )
| A. | 加热氯酸钾 | B. | 加热高锰酸钾 | C. | 电解水 | D. | 分离空气 |
2.在同温同压下,下列各组热化学方程式中,Q2>Q1的是( )
| A. | 2H2(g)+O2(g)=2H2O(g)△H=-Q1kJ/mol; 2H2(g)+O2(g)=2H2O(g))△H=-Q2kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)△H=-Q1kJ/mol; S(s)+O2(g)=SO2(g))△H=-Q2kJ/mol | |
| C. | C(s)+O2(g)=CO2(g))△H=-Q1kJ/mol; C(s)+O2(g)=CO(g))△H=-Q2kJ/mol | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H=-Q1kJ/mol; H2(g)+Cl2(g)=HCl(g))△H=-Q2kJ/mol |
19.某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿氏常数,下列说法中正确的是( )
| A. | 氧元素的相对原子质量为 | B. | 1mol该原子质量为aNAg | ||
| C. | x g该氧原子所含的电子数为 | D. | y g 该氧原子的中子数一定为 |
17.碳及其化合物在工农业生产生活中有着重要作用.请按要求回答下列问题:

(1)已知:C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1;
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
将水蒸气喷到灼热的炭上可实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g),△H=+132kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为2L的恒容密闭容器中,一定条件下发生反应为CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组实验数
①该反应的正反应为放热(填“吸热”或“放热”)反应.
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.4mol/(L•min).若在此温度下H2O(g)、CO(g)起始量分别为2mol、4mol,则此反应的平衡常数为.
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图1坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作标注实验编号.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池的负极反应式为CH3OH-6e-+8OH-═CO32-+6H2O.
(4)一定条件下,如图2示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为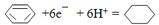 .
.

(1)已知:C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1;
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
将水蒸气喷到灼热的炭上可实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g),△H=+132kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为2L的恒容密闭容器中,一定条件下发生反应为CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组实验数
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.4mol/(L•min).若在此温度下H2O(g)、CO(g)起始量分别为2mol、4mol,则此反应的平衡常数为.
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图1坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作标注实验编号.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池的负极反应式为CH3OH-6e-+8OH-═CO32-+6H2O.
(4)一定条件下,如图2示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为
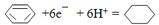 .
.