题目内容
6.在标准状况下,在三个干燥的烧瓶内分别装有干燥、纯净的NH3;含一半空气的氯化氢气体;NO2和O2体积比为4:1的混合气体.然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )| A. | 2:1:2 | B. | 5:5:4 | C. | 1:1:1 | D. | 无法确定 |
分析 设出烧瓶体积,根据n=$\frac{V}{{V}_{m}}$计算出烧瓶中气体的物质的量,干燥、纯净的NH3中溶液充满烧瓶,含一半空气的氯化氢气体形成的溶液体积为烧瓶容积的一半,根据c=$\frac{n}{V}$计算出溶液的浓度;根据反应4NO2+O2+2H2O=4HNO3计算出反应后溶质的物质的量,再根据c=$\frac{n}{V}$计算出硝酸的浓度,最后计算出三个烧瓶中所得溶液的物质的量浓度之比.
解答 解:假设烧瓶体积为5VL,则干燥纯净的氨气体积为5VL完全溶于水后烧瓶充满溶液溶液体积也是5VL,溶质物质的量浓度为:$\frac{\frac{5VL}{22.4L/mol}}{5VL}$=$\frac{1}{22.4}$mol/L;
含一半空气的氯化氢烧瓶中氯化氢体积为2.5V完全溶解后烧瓶进水$\frac{1}{2}$,也就是溶液体积为2.5V,所以溶质物质的量浓度为:$\frac{\frac{2.5VL}{22.4L/mol}}{2.5VL}$=$\frac{1}{22.4}$mol/L;
二氧化氮与氧气体积比为4:1的混合气中NO2体积为4VL,根据以下方程式恰好完全反应:4NO2+O2+2H2O=4HNO3,而且生成硝酸物质的量为:$\frac{4VL}{22.4L/mol}$=$\frac{4V}{22.4}$mol,
由于完全反应所以烧瓶充满溶液其体积为5VL,所以溶质的物质的量浓度为:$\frac{\frac{4V}{22.4}mol}{5V}$=$\frac{1}{28}$mol/L,
所以三个烧瓶中所得溶液的溶质的物质的量浓度之比为:=$\frac{1}{22.4}$mol/L:=$\frac{1}{22.4}$mol/L:$\frac{1}{28}$mol/L=5:5:4,
故选B.
点评 本题考查物质的量浓度的计算,题目难度中等,解答时要把握二氧化氮与水反应的性质,然后根据物质的量浓度的计算公式进行计算.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案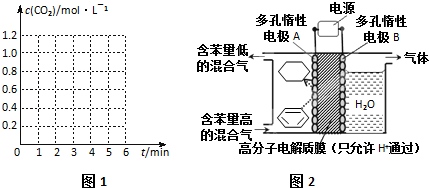
(1)已知:C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1;
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
将水蒸气喷到灼热的炭上可实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g),△H=+132kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为2L的恒容密闭容器中,一定条件下发生反应为CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组实验数
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.4mol/(L•min).若在此温度下H2O(g)、CO(g)起始量分别为2mol、4mol,则此反应的平衡常数为$\frac{8}{3}$.
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图1坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作标注实验编号.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池的负极反应式为CH3OH-6e-+8OH-═CO32-+6H2O.
(4)一定条件下,如图2示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为
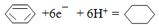 .
. | A. | ①③⑤ | B. | ①②③ | C. | ②④ | D. | ①③④⑤ |
| A. | 标准状况下,33.6 L 氟化氢中含有氟原子的数目为1.5NA | |
| B. | pH均为5的NH4Cl和NaHSO4溶液中水电离出的氢离子数目均为10-5NA | |
| C. | 在1L 0.1 mol•L-1CuSO4溶液中,阴离子总数大于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molIH2,在一定条件下充分反应,转移电子的数目为 NA |
| A. | 其水溶液显酸性,俗称石碳酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |
| A | C | |
| B |
(2)B位于元素周期表中第三周期,第ⅥA族;
(3)C的原子结构示意图为
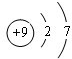 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
| A. | 直馏汽油 | B. | 裂化汽油 | C. | 酒精 | D. | 己烷 |
 6
6 7
7 6
6 6.
6.