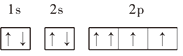
题目内容
【题目】工业制硫酸工艺的催化氧化反应原理是:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
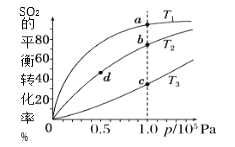
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c)、υ(b)>υ(d)
C.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
D.平衡常数:K(a)>K(c)、K(b)>K(d)
【答案】C
【解析】
A.该反应的正反应为放热反应,温度升高,平衡逆向移动,二氧化硫转化率减小,T1<T2<T3,A错误;
B.温度越高,反应速率越快,υ(a)< υ(c),压强增大,反应速率加快,υ(b)> υ(d),B错误;
C.温度升高,平衡逆向移动,气体总质量不变,但总物质的量增大,所以平均摩尔质量:M(a)>M(c),压强增大,平衡正向移动,平均摩尔质量增大,M(b)>M(d),C正确;
D.平衡常数只与温度有关,该反应的正反应为放热反应,温度升高,平衡常数减小,
K(a)> K(c)、K(b)= K(d),D错误;故答案为:C。

练习册系列答案
相关题目