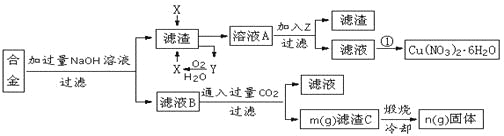
题目内容
【题目】已知2H2(g)+O2(g)→2H2O(g)+483.6kJ。下列说法或表达正确的是( )
A.在相同的条件下,2mol氢气与1mol氧气的总能量小于2mol水蒸气的总能量
B.H2(g)+![]() O2(g)→H2O(1)+Q1;Q1>241.8kJ
O2(g)→H2O(1)+Q1;Q1>241.8kJ
C.氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生
D.任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量
【答案】B
【解析】
A.反应放热,则在相同的条件下,2mol氢气与1mol氧气的总能量大于2mol水蒸气的总能量,A错误;
B.H2O(g)→H2O(l),放出热量,则H2(g)+![]() O2(g)→H2O(1)+Q1,则Q1>241.8kJ,B正确;
O2(g)→H2O(1)+Q1,则Q1>241.8kJ,B正确;
C.氢气燃烧是放热反应,燃烧需要点燃,需要外界能量引发反应,C错误;
D.化学计量数表示的是各物质的物质的量,而不是体积,因此不能判断2L水蒸气分解吸收的热量,D错误。
答案选B。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目