��Ŀ����
����Ŀ��Ǧ���仯������������ء������豸��X���߷������ϣ���֪Pb�Ļ��ϼ�ֻ��0��+2��+4���ش��������⣺
��1��PbO2��PbO�Ļ�����У�Pb��O�����ʵ���֮��Ϊ8��11���������У�PbO2��PbO�����ʵ���֮��Ϊ___��
��2����������CO��ԭ13.7gijǦ����������ɵ�CO2ȫ��ͨ�뵽�����ij���ʯ��ˮ�У��õ��ij������������Ϊ8.0g�����Ǧ������Ļ�ѧʽ�ɱ�ʾΪ___��
��3��PbO2����ǿ�����ԣ�������ŨHCl����Cl2��+4�۵�Pb����ԭ��+2�۵�Pb��+2�۵�Pb���߱������ʣ���������Ϣ�ش����⣺�ٽ�amolPbO2���ȷֽ�һ��ʱ�䣬����PbO��O2���ڽ������ù������������Ũ���ᣬ�ռ�������Cl2����֪�ڢټ���һ��ʱ���ʣ��Ĺ����У�+2�۵�PbռǦԪ����������Ϊx����Ӧ���������ɵ��������������ʵ����ܺ��Ƕ���___��
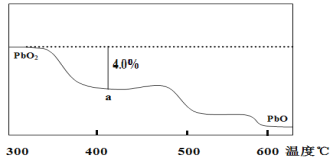
��4��PbO2�ڼ��ȹ��̷����ֽ��ʧ��������ͼ��ʾ����֪ʧ�������ϵ�a��Ϊ��Ʒʧ��4.0%��������Ʒ��ʼ������a�����������/��Ʒ��ʼ������100%���IJ������塣��a�������ɱ�ʾΪPbOx��mPbO2��nPbO����ʽ����xֵ��m��nֵ___��___��
���𰸡�3��5 Pb3O4��PbO2��2PbO a(1-![]() )mol x=1.4 m��n=2��3
)mol x=1.4 m��n=2��3
��������
(1)��������PbO2��PbO�����ʵ����ֱ�Ϊxmol��ymol��Ȼ�����Ǧ���������ʵ���֮����⣻
(2)�������������8.0gΪCaCO3���������ݴ����CO2�����ʵ���������CO2�����ʵ��������Ǧ����������ԭ�ӵ����ʵ�������Ԫ�ص��������ټ����ǦԪ�ص�������Ǧԭ�ӵ����ʵ������ݴ���д��ѧʽ��
(3)����������ԭ��Ӧ�ı��ʵ��ӵ�ʧ�غ����n(O2)��n(Cl2)���������ɵ��������������ʵ����ܺ�x�ĺ�����ϵ��
(4)��a�������ɱ�ʾΪPbOx������PbO2![]() PbOx+
PbOx+![]() O2���з��̼���x��ֵ������ɱ�ʾΪmPbO2nPbO����Oԭ����Pbԭ�ӵı�ֵΪx���ݴ˼�����
O2���з��̼���x��ֵ������ɱ�ʾΪmPbO2nPbO����Oԭ����Pbԭ�ӵı�ֵΪx���ݴ˼�����
(1)��������PbO2��PbO�����ʵ����ֱ�Ϊxmol��ymol����(x+y)��(2x+y)��8��11����֮��x��y��3��5��
(2)�������������8.0gΪ̼�������������̼��Ƶ����ʵ���Ϊ![]() ���������е���ԭ�ӱ�CO��ȡ����CO2������̼Ԫ�ء���Ԫ���غ㣬��֪CO��O��CO2��CaCO3������Ǧ�������е���ԭ�ӵ����ʵ���Ϊ0.08mol����Ԫ�ص�����Ϊ0.08mol��16g/mol��1.28g������Ǧ�������е�ǦԪ�ص�����Ϊ13.7g��1.28g��12.42g��Ǧԭ�ӵ����ʵ���Ϊ
���������е���ԭ�ӱ�CO��ȡ����CO2������̼Ԫ�ء���Ԫ���غ㣬��֪CO��O��CO2��CaCO3������Ǧ�������е���ԭ�ӵ����ʵ���Ϊ0.08mol����Ԫ�ص�����Ϊ0.08mol��16g/mol��1.28g������Ǧ�������е�ǦԪ�ص�����Ϊ13.7g��1.28g��12.42g��Ǧԭ�ӵ����ʵ���Ϊ![]() ��0.06mol������Ǧ��������Ǧԭ������ԭ�ӵ����ʵ���֮��Ϊ0.06mol��0.08mol��3��4�����Ǧ������Ļ�ѧʽ�ɱ�ʾΪPb3O4��PbO2��2PbO��
��0.06mol������Ǧ��������Ǧԭ������ԭ�ӵ����ʵ���֮��Ϊ0.06mol��0.08mol��3��4�����Ǧ������Ļ�ѧʽ�ɱ�ʾΪPb3O4��PbO2��2PbO��
(3)�������⣺amolPbO2�ֽ����û������n(Pb2+)��axmol��n(Pb4+)��(1-x)amol���ڷ�Ӧ������amolPbO2��+4�۵�Pb����ǿ����������������+4�۵�Pb����ȫ������Ϊ+2�ۡ����ݵ�ʧ�����غ㣺�ȼ��ȷֽ�����O2��Pb�Ļ��ϼ۴ӣ�4���͵���2��n(Pb2+)��axmol����õ����ӵ����ʵ���Ϊ2axmol��O�Ļ��ϼ۴ӣ�2���ߵ�0������1molO2��Ҫʧȥ4mol���ӣ���n(O2)��![]() amol��
amol��![]() amol��������������Ũ���ᷴӦ����Cl2��ʣ���Pb(4��)ȫ��ת��Ϊ��2�ۣ�n(Pb4+)��(1-x)amol����õ����ӵ����ʵ���Ϊ2(1-x)amol������1molCl2����Ҫת��2mol���ӣ���n(Cl2)��
amol��������������Ũ���ᷴӦ����Cl2��ʣ���Pb(4��)ȫ��ת��Ϊ��2�ۣ�n(Pb4+)��(1-x)amol����õ����ӵ����ʵ���Ϊ2(1-x)amol������1molCl2����Ҫת��2mol���ӣ���n(Cl2)��![]() mol��(1-x)amol������n(O2)+n(Cl2)��
mol��(1-x)amol������n(O2)+n(Cl2)��![]() amol+(1-x)amol��(1-
amol+(1-x)amol��(1-![]() )amol��
)amol��
(4)��a�������ɱ�ʾΪPbOx������PbO2![]() PbOx+
PbOx+![]() O2����
O2���У�![]() ��32��239��4.0%�����x��1.4������ɱ�ʾΪmPbO2nPbO����Oԭ����Pbԭ�ӵı�ֵΪx����
��32��239��4.0%�����x��1.4������ɱ�ʾΪmPbO2nPbO����Oԭ����Pbԭ�ӵı�ֵΪx����![]() ��1.4��������m��n��2��3��
��1.4��������m��n��2��3��