题目内容
【题目】2018年11月《物理评论快报》报道了艾姆斯实验室制造的包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料,呈现出被称为刺猬自旋新磁态。有助于更好理解磁性与非常规超导性之间的联系。回答下列问题:
(1)基态镍原子的电子排布式为[Ar]______________;上述材料中所含元素的基态原子中,未成对电子数最多的是___________(填元素符号)。
(2)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)6]4-、Fe(CO)5等。所包括的非金属元素中第一电离能最大的是__________(填元素符号);
(3)K3AsO3可用于碘的微量分析。
①K+的焰色反应呈紫色,金属元素能产生焰色实验的微观原因为____________。
②AsO33-的立体构型为________,写出一种与其互为等电子体的分子________
(填化学式)。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。
(5)①金属镍的原子堆积方式如图所示,则金属镍晶胞俯视图为____。

A.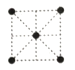 B.
B. C.
C. D.
D.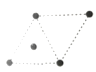
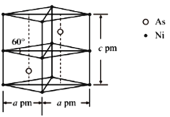
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=_____g·cm-3。
【答案】3d84s2 Fe N 电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量 三角锥形 PCl3、PBr3、NF3、NCl3等(答一种即可) Ni的原子半径较小,价层电子数目较多,金属键较强 C ![]()
【解析】
(1)镍是28号元素,根据构造原理写出电子排布式,根据钙、钾、铁和砷以及镍的核外电子排布式,找出未成对电子数最多的;
(2)非金属元素C、N、O、根据它们在周期表的位置,N的核外电子排布中,2p轨道为半充满,N的第一电离能高于同周期相邻的元素,判断第一电离能的大小;
(3).①电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量;
②AsO33-中As原子孤电子对数=![]() =1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型;互为等电子体的微粒的原子总数相等、价电子总数也相等;
=1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型;互为等电子体的微粒的原子总数相等、价电子总数也相等;
(4).金属晶体熔沸点的高低与金属键的强弱有关,金属键的强弱与价层电子数目和金属原子的半径有关;
(5) ①镍的原子堆积方式为面心立方最密堆积;②由晶胞结构可知,每个晶胞中含有2个Ni原子和2个As原子,计算晶胞的质量,晶体密度=晶胞质量÷晶胞体积。
(1)镍是28号元素,根据构造原理写出简化的电子排布式[Ar] 3d84s2,
钙、钾、铁和砷以及镍的核外电子排布式:[Ar]4s2、[Ar]4s1、[Ar]3d64s2、[Ar]3d104s24p3、[Ar]3d84s2,未成对电子数分别为0、1、4、3、2,基态原子中,未成对电子数最多的是铁,
故答案为:[Ar] 3d84s2;Fe;
(2)同周期从左到右,第一电离能呈现增大的趋势,由于氮原子的2p能级为半充满,较稳定,故C、N、O的第一电离能大小顺序为C<O<N,第一电离能较大的元素为N,
故答案为:N;
(3)①金属元素产生焰色反应的微观原因为:电子从较高能级的激发态跃迁到较低能级的激发态乃至基态 时,会以光的形式释放能量,产生焰色反应,
故答案为:电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量;
②AsO33中As原子孤电子对数=![]() =1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型为三角锥形;根据价电子总数和原子总数(氢等轻原子不计在内)相同的分子、离子或基团互为等电子体可知,用Cl原子替代O原子、1个单位负电荷可得与AsO33互 为等电子体的分子有PCl3等,进一步替换可得PBr3、NF3、NCl3等,
=1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型为三角锥形;根据价电子总数和原子总数(氢等轻原子不计在内)相同的分子、离子或基团互为等电子体可知,用Cl原子替代O原子、1个单位负电荷可得与AsO33互 为等电子体的分子有PCl3等,进一步替换可得PBr3、NF3、NCl3等,
故答案为:三角锥形;PCl3、PBr3、NF3、NCl3等;
(4)Ca、Ni都属于金属晶体,Ni的原子半径较小,价层电子数目较多,金属键较强,故金属Ni的熔点和沸点均比金属Ca的高,
故答案为:Ni的原子半径较小,价层电子数目较多,金属键较强;
(5) ①镍的原子堆积方式为面心立方最密堆积,故金属镍晶胞俯视图为C,
答案为C;
②由晶胞结构可知,每个晶胞中含有Ni原子数目=8×![]() +4×
+4×![]() =2,含有2个As原子,晶胞的质量=2×
=2,含有2个As原子,晶胞的质量=2×![]() g,晶胞的体积V=a×10-10cm×a×10-10cm×
g,晶胞的体积V=a×10-10cm×a×10-10cm×![]() ×c×10-10cm=
×c×10-10cm=![]() ×10-30cm3,故晶胞的密度ρ=
×10-30cm3,故晶胞的密度ρ=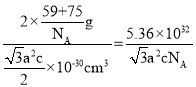 g·cm-3,
g·cm-3,
故答案为:![]() 。
。