题目内容
【题目】某烟道气的主要成分是CO2,并含有少量硫氧化物、氮氧化物等杂质。其中的硫元素可在高温下通过CH4的作用回收,主要反应如下:2SO2(g)+CH4(g)CO2(g)+2H2O(g)+S2(g)+Q(Q>0)
(1)以mol/(Lmin)为单位,SO2的反应速率是S2生成速率的_________倍。
(2)恒容条件下,不能说明该反应已经达到平衡状态的是_______(选填编号)
a.混合气体中水蒸气含量不再变化
b.混合气体密度不发生变化
c.容器内压强不再变化
d.混合物平均相对分子质量不再变化
达到平衡后升高体系温度,则平衡常数K_________(填“增大”、“减小”、或“不变”)。
(3)请在下式中标出上述反应中电子转移的方向和数目:_____
2SO2(g)+CH4(g)…该反应的氧化产物是_________。SO2的主要性质除氧化性、漂白性外还有________性。
(4)该反应混合物中有两种极性分子,分别是______和_____;固态硫的分子式可能是S8,它与S2互为________。
(5)烟道气中的NO2也能与CH4反应并生成无害气体,完全转化3.0molNO2气体时,需要甲烷的物质的量为__________mol.
【答案】2 b 减小 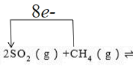 CO2 酸性氧化物 SO2 H2O 同素异形体 1.5
CO2 酸性氧化物 SO2 H2O 同素异形体 1.5
【解析】
(1)根据反应方程式分析,每消耗2molSO2,生成1molS2(g),则SO2的反应速率是S2生成速率的2倍;
(2)a.反应达到平衡时,各物质的浓度不再改变,所以混合气体中水蒸气含量不再变化,能说明化学反应是否达到平衡,故a不选;
b.反应物和生成物均为气体的反应,气体总质量反应前后质量守恒,保持不变,恒容容器体积不发生改变,则整个反应达到化学平衡前后,混合气体的密度都不变,不能根据密度说明化学反应是否达到平衡,故b选;
c.随着反应进行,气体分子数增加,气体压强增大,当容器内压强不再变化时,可以说明化学反应是否达到平衡,故c不选;
d.反应前后质量守恒,混合气体总质量不变,随着反应进行,混合气体的物质的量发生改变,所以当混合物平均相对分子质量不再变化时,可以说明反应是否达到平衡,故d不选;
综上所述答案为b;
该反应为放热反应,达到平衡后升高体系温度,平衡左移,平衡常数K减小;
(3)反应为氧化还原反应,SO2做氧化剂,在反应中得到电子,CH4做还原剂,在反应中失去电子,根据电子守恒可得电子转移数目为8,所以答案为: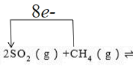 ;
;
反应中C元素化合价升高,氧化产物是CO2,SO2的主要性质除氧化性、漂白性外还有还原性和酸性氧化物的性质;
(4)极性分子是指分子中正负电荷中心不重合的分子,则分别是SO2和H2O;S8与S2为S元素的不同单质,互为同素异形体;
(5)烟道气中的NO2也能与CH4反应并生成无害气体,可判断为CO2和H2O和N2,反应的化学方程式为:2NO2+CH4=CO2+N2+2H2O,完全转化3.0molNO2气体时,根据反应方程式计算,则需要甲烷的物质的量为1.5mol。