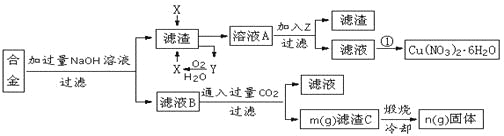
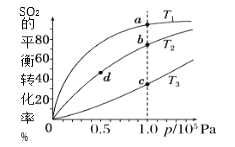
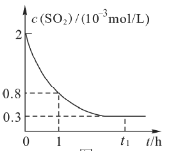
题目内容
【题目】下列基态原子或离子的电子排布式(图)正确的是______(填序号,下同),违反能量最低原理的是______,违反洪特规则的是______,违反泡利原理的是______.
①![]() :
:![]()
②![]() :
:![]()
③P: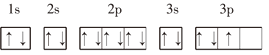
④Cr:![]()
⑤Fe:![]()
⑥![]() :
:![]()
⑦O: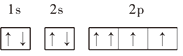
【答案】①⑤⑥ ② ③④ ⑦
【解析】
根据构造原理,利用核外电子排布的三个原理:能量最低原理、泡利原理、洪特规则可对各项作出判断。
①Ca的电子排布式为:1s22s22p63s23p64s2,失去4s能级上的2个电子变成具有稀有气体电子层结构的Ca2+:1s22s22p63s23p6,离子的电子排布式书写正确;
②②离子的电子排布违反了能量最低原理,能量:2p<3p,F-核外电子排布应表示为:1s22s22p6;
③P的3p能级上的3个电子没有独占1个轨道,违反了洪特规则,正确的电子排布图为: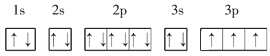
④Cr的价电子构型应为:3d54s1,3d轨道半充满状态更稳定,此为洪特规则特例,所以④违反了洪特规则;
⑤Fe原子序数为26,电子排布式为:1s22s22p63s23p63d64s2,书写正确;
⑥Mg的电子排布式为:1s22s22p63s2,失去3s能级上的2个电子变成具有稀有气体电子层结构的Mg2+:1s22s22p6,离子的电子排布式书写正确;
⑦O电子排布图2p能级的1个轨道上的一对电子自旋方向相同,违反了泡利原理,应表示为:![]() ;
;
总之,基态原子或离子的电子排布式(图)正确的是①⑤⑥,违反能量最低原理的是②,违反洪特规则的是③④,违反泡利原理的是⑦。答案为:①⑤⑥;②;③④;⑦。

练习册系列答案
相关题目