题目内容
18.某元素的单质0.3mol与足量的水反应,可生成标准状况下的氢气3.36L.反应生成的该元素离子有10个电子,该元素是( )| A. | Na | B. | Cl | C. | K | D. | S |
分析 n(H2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,由电子守恒计算单质失去电子后化合物中元素的化合价,再由生成的该元素离子有10个电子计算质子数,从而确定元素.
解答 解:n(H2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,设反应后元素的化合价为x,
由电子守恒可知,0.3mol×(x-0)=0.15mol×2×(1-0),
解得x=1,
反应生成的该元素离子有10个电子,则元素的质子数为10+1=11,即为Na,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子守恒及金属失去电子为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列关于有机化合物的说法正确的是( )
| A. | 棉花和蛋白质都是高分子化合物,水解产物相同 | |
| B. | 苯和己烯都能使溴水褪色,均与溴水发生加成反应 | |
| C. | 可用碳酸氢钠溶液鉴别乙酸和乙醇 | |
| D. | 用溴水除去甲烷中混有的少量乙烷气体 |
6.下列溶液颜色的变化不是因为化学反应而引起的( )
| A. | 实验室的浓硝酸通常显黄色 | B. | Fe(NO3)2溶液中滴入稀盐酸 | ||
| C. | NO2气体遇湿润的淀粉KI试纸变蓝 | D. | 将活性炭加入红墨水中褪色 |
13.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
3.工业上常用稀硫酸清洗铁表面的锈层,这是利用硫酸的( )
| A. | 强氧化性 | B. | 不挥发性 | C. | 吸水性 | D. | 酸性 |
10.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和脂肪,苯和汽油 | |
| B. | 油脂和水,溴苯和水,硝基苯和水 | |
| C. | 甲醛和水,蚁酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和甲苯,鸡蛋白和水 |
7.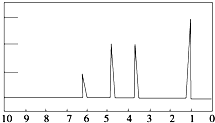 1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的1H核磁共振谱如图所示:则该物质可能是下列中的( )
1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的1H核磁共振谱如图所示:则该物质可能是下列中的( )
 1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的1H核磁共振谱如图所示:则该物质可能是下列中的( )
1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的1H核磁共振谱如图所示:则该物质可能是下列中的( )| A. | CH3CH2CH3 | B. | CH3CH2CH2OH | C. | CH3CH2CH2CH3 | D. | CH3CH2OH |
8.一定量CH4不完全燃烧得到49.6g CO2、CO和水蒸气的混合气体,让其通过浓H2SO4时浓硫酸增重25.2g,则混合气体中CO2的质量为( )
| A. | 12.5g | B. | 13.2g | C. | 19.7g | D. | 24.4g |

 +H2O.
+H2O.