题目内容
9.完成下列化学方程式(1)向苯酚钠溶液中通入少量CO2C6H5ONa+CO2+H2O→C6H6OH+NaHCO3
(2)以甲苯为主要原料制TNT(三硝基甲苯)

(3)溴乙烷与NaOH的乙醇溶液共热CH3CH2Br+NaOH $→_{△}^{醇}$CH2=CH2↑+NaBr+H2O
(4)乳酸(2-羟基丙酸)分子间酯化为六元环酯的反应2CH3CHOHCOOH→
 +H2O.
+H2O.
分析 (1)苯酚钠通入二氧化碳生成苯酚和碳酸氢钠;
(2)根据甲苯与浓硫酸和浓硝酸的混酸加热反应生成三硝基甲苯和水发生的是取代反应进行解答;
(3)溴乙烷与NaOH的乙醇溶液共热,发生消去反应生成乙烯;
(4)2-羟基丙酸CH3CH(OH)COOH,分子间酸脱羟基、醇脱氢发生酯化反成六元环酯.
解答 解:(1)碳酸的酸性比苯酚的酸性强,所以苯酚钠通入二氧化碳生成苯酚和碳酸氢钠,反应的化学方程式为:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3;
(2)甲苯可以和浓硝酸之间发生取代反应生成2,4,6-三硝基甲苯,即TNT,反应的化学方程式为: ;
;
故答案为: ;
;
(3)溴乙烷与NaOH的乙醇溶液共热,发生消去反应生成乙烯,溴乙烷与氢氧化钠乙醇溶液加热反应方程式:CH3CH2Br+NaOH $→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,
故答案为:CH3CH2Br+NaOH $→_{△}^{醇}$CH2=CH2↑+NaBr+H2O;
④2-羟基丙酸CH3CH(OH)COOH,发生酯化反,酸脱羟基、醇脱氢,分子间脱水形成的含六元环的化合物,反应为2CH3CHOHCOOH→ +H2O,
+H2O,
故答案为:2CH3CHOHCOOH→ +H2O.
+H2O.
点评 本题考查有机物的机构和性质,为高考常见题型,注意把握有机物的官能团的性质以及相关方程式的书写,为解答该题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.常温常压下,下列气体混合后压强一定不发生变化的是( )
| A. | NH3和Cl2 | B. | NH3和HBr | C. | SO2和O2 | D. | SO2和H2S |
20. Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Mn元素的原子结构示意图为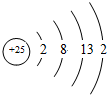 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子都具备的结构特点是有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中的配体CN-中C原子的杂化轨道类型是sp,写出一种与CN-互为等电子体的单质分子的结构式N≡N;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚.丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
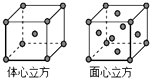
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(5)假设体心立方晶胞的铁原子半径为r,晶胞的边长为a,则该晶胞的空间利用率是68%.
 Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元素 | Mn | Fe | |
| 电离能 KJ/mol | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Mn元素的原子结构示意图为
 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子都具备的结构特点是有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中的配体CN-中C原子的杂化轨道类型是sp,写出一种与CN-互为等电子体的单质分子的结构式N≡N;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚.丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(5)假设体心立方晶胞的铁原子半径为r,晶胞的边长为a,则该晶胞的空间利用率是68%.
17.最新报道,科学家又发现了某元素的一种原子,它的原子核内有161个中子,质量数为272.该元素的原子序数为( )
| A. | 111 | B. | 161 | C. | 272 | D. | 433 |
14.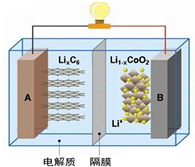 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 充电时Li+从右边流向左边 | |
| B. | 放电时,正极锂的化合价未发生改变 | |
| C. | 充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
1.①Cl2比S容易与H2化合;
②Cl2能从Na2S溶液中置换出S;
③HClO3酸性比H2SO3的酸性强;
④与Fe反应时Cl2能生成高价铁化合物,S只能生成低价铁化合物;
⑤Cl2熔沸点比S的低.
能说明Cl比S的非金属性强是( )
②Cl2能从Na2S溶液中置换出S;
③HClO3酸性比H2SO3的酸性强;
④与Fe反应时Cl2能生成高价铁化合物,S只能生成低价铁化合物;
⑤Cl2熔沸点比S的低.
能说明Cl比S的非金属性强是( )
| A. | 只有④ | B. | ①②④ | C. | ①②③④ | D. | ①②③④⑤ |
19.下列物质性质的变化规律与分子间作用力有关的是( )
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的沸点依次升高 |
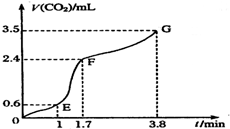 现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题: