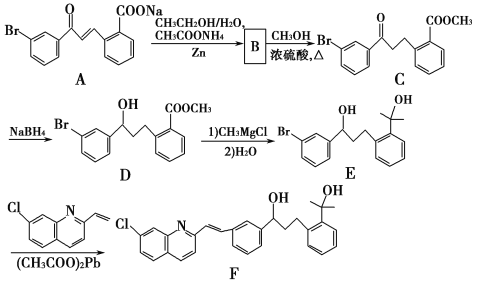
题目内容
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
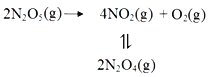
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4 kJ· mol-1
N2O4(g)![]() 2NO2(g) △H2=+55.3 kJ· mol-1
2NO2(g) △H2=+55.3 kJ· mol-1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的 △H=________kJ· mol-1。
O2(g)的 △H=________kJ· mol-1。
(2)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强介p∞(35℃)______63.1kPa(填“大于”“等于”或“小于”),原因是________________________________________________。
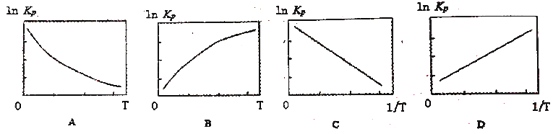
(3)25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
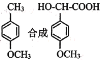
(4)邻二甲苯经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX)。某研究小组研究了采用N2O5为硝化剂时催化剂用量对该反应的影响。将一定量的催化剂和邻二甲苯置于反应瓶中,控制温度反应一定时间。测得邻二甲苯的转化率和3-NOX的选择性如图所示:
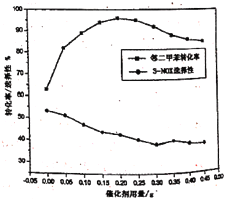
①描述并解释随着催化剂用量的增加,邻二甲苯转化率的变化趋势:____________。
②在图中画出4-NOX的选择性随催化剂用量变化的曲线_____________。
【答案】+53.1 大于 温度升高,容器容积不变,且二氧化氮二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高 13.4 BC 反应一定时间并未达到平衡状态,当催化加用量在0-0.20g时随着用量的增加反应速率加快,邻二甲苯转化率增加;当催化剂用量超过0.20g时大量的催化剂可能会催化N2O5的分解,导致邻二甲苯转化率降低 
【解析】
(1) 已①2N2O5(g)=2N2O4(g)+O2(g)△H1=4.4kJ/mol、②2NO2(g)=N2O4(g)△H2=+55.3kJ/mol,根据盖斯定律可知,![]() ①②即得到N2O5(g)=2NO2(g)+
①②即得到N2O5(g)=2NO2(g)+![]() O2(g),据此计算△H的值;
O2(g),据此计算△H的值;
(2)温度升高,容器容积不变,且二氧化氮二聚为吸热反应,温度提高,平衡右移,体系物质的量增加,总压强提高;
(3)根据五氧化二氮完全分解时的压强计算出二氧化氮、氧气的压强,然后再根据二氧化氮转化的方程式计算平衡时二氧化氮、四氧化二氮的压强;根据2NO2(g)=N2O4(g)△H2=+55.3kJ/mol,反应吸热,升高温度,平衡右移,平衡常数增大,则平衡常数的对数增大,但不是线性关系;升高温度,T增大,![]() 减小,平衡左移,平衡常数减小,则平衡常数的对数减小,线性关系;
减小,平衡左移,平衡常数减小,则平衡常数的对数减小,线性关系;
(4) ①根据图像,反应一定时间并未达到平衡状态,当催化加用量在0-0.20g时随着用量的增加反应速率加快,邻二甲苯转化率增加;当催化剂用量超过0.20g时大量的催化剂可能会催化N2O5的分解,导致邻二甲苯转化率降低;
②根据题意,邻二甲苯在催化剂作用下经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX),催化剂的用量影响邻二甲苯反应发生转化进行的方向,根据图像显示,催化剂用量越多,3-硝基邻二甲苯(3-NOX)生成量越少,反应越向着生成4-硝基邻二甲苯(4-NOX)反应进行,二者的生成量应关于邻二甲苯的转化率50%呈对称分布,或者说二者生成之和为100%,根据3-硝基邻二甲苯(3-NOX)选择性曲线呈对称分布画出曲线;
(1) 已①2N2O5(g)=2N2O4(g)+O2(g)△H1=4.4kJ/mol、②2NO2(g)=N2O4(g)△H2=+55.3kJ/mol,根据盖斯定律可知,![]() ①②即得到N2O5(g)=2NO2(g)+
①②即得到N2O5(g)=2NO2(g)+![]() O2(g)△H=+53.1kJ/mol,
O2(g)△H=+53.1kJ/mol,
故答案为:+53.1;
(2)由于温度升高,容器容积不变,总压强提高,且二氧化氮二聚为吸热反应,温度提高,平衡右移,体系物质的量增加,总压强提高,所以若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)大于63.1kPa,
故答案为:大于;温度升高,容器容积不变,且二氧化氮二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高;
(3)根据表中数据可知五氧化二氮完全分解时的压强是63.1kPa,根据方程式可知完全分解时最初生成的二氧化氮的压强是35.8kPa×2=71.6kPa,氧气是35.8kPa×![]() =17.9kPa,总压强应该是71.6kPa+17.9kPa=89.5kPa,平衡后压强减少了89.5kPa63.1kPa=26.4kPa,所以根据方程式2NO2(g)N2O4(g)可知,平衡时四氧化二氮对应的压强是26.4kPa,二氧化氮对应的压强是71.6kPa26.4kPa×2=18.8kPa,则反应的平衡常数Kp=
=17.9kPa,总压强应该是71.6kPa+17.9kPa=89.5kPa,平衡后压强减少了89.5kPa63.1kPa=26.4kPa,所以根据方程式2NO2(g)N2O4(g)可知,平衡时四氧化二氮对应的压强是26.4kPa,二氧化氮对应的压强是71.6kPa26.4kPa×2=18.8kPa,则反应的平衡常数Kp=![]() ≈13.4kPa;根据2NO2(g)=N2O4(g)△H2=+55.3kJ/mol,反应吸热,升高温度,平衡右移,平衡常数增大,则平衡常数的对数增大,但不是线性关系;升高温度,T增大,
≈13.4kPa;根据2NO2(g)=N2O4(g)△H2=+55.3kJ/mol,反应吸热,升高温度,平衡右移,平衡常数增大,则平衡常数的对数增大,但不是线性关系;升高温度,T增大,![]() 减小,平衡左移,平衡常数减小,则平衡常数的对数减小,线性关系,故答案选BC。
减小,平衡左移,平衡常数减小,则平衡常数的对数减小,线性关系,故答案选BC。
故答案为:13.4;BC;
(4) ①根据图像,反应一定时间并未达到平衡状态,当催化加用量在0-0.20g时随着用量的增加反应速率加快,邻二甲苯转化率增加;当催化剂用量超过0.20g时大量的催化剂可能会催化N2O5的分解,导致邻二甲苯转化率降低,
故答案为:反应一定时间并未达到平衡状态,当催化加用量在0-0.20g时随着用量的增加反应速率快,邻二甲苯转化率增加;当催化剂用量超过0.20g时大量的催化剂可能会催化N2O5的分解,导致邻二甲苯转化率降低;
②根据题意,邻二甲苯在催化剂作用下经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX),催化剂的用量影响邻二甲苯反应发生转化进行的方向,根据图像显示,催化剂用量越多,3-硝基邻二甲苯(3-NOX)生成量越少,反应越向着生成4-硝基邻二甲苯(4-NOX)反应进行,二者的生成量应关于邻二甲苯的转化率50%呈对称分布,或者说二者生成之和为100%,则4-NOX的选择性随催化剂用量变化的曲线为 ,
,
故答案为: 。
。