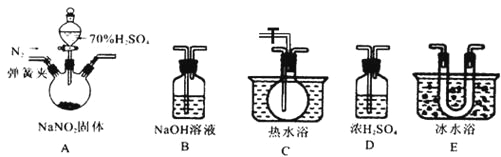
题目内容
【题目】药物阿莫西林能杀灭或抑制细菌繁殖,它的合成路线如下:
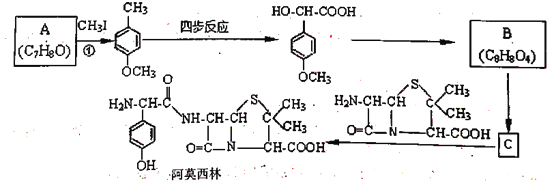
已知:1.两个羟基同时连在同一个碳原子上的结构是不稳定的,它将发生脱水反应
![]()
![]()
![]() +H2O
+H2O
2.RCHO![]()
![]()
![]()
![]()
(1)关于阿莫西林分子,下列说法正确的是_______________。
A.分子式为C16H18N3O5 B.分子中含4个手性碳原子
C.1 mol该物质最多能与3mol NaOH反应 D.能发生取代、加成、氧化、缩聚等反应
(2)反应①的化学方程式为_______________,CH3I的作用为__________。
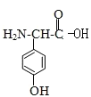
(3)写出甘氨酸(H2N-CH2-COOH)和C发生缩合生成二肽的结构简式: ________。
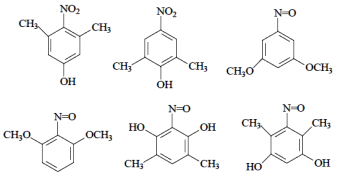
(4)试写出3种同时满足下列条件的化合物C的同分异构体:___________。
①分子中含苯环,不含过氧键“-O-O-”;
②分子中含有3种不同化学环境的氢原子。
(5)利用己有知识和题中涉及的反应,设计从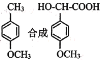 的路线。(用流程图表示,无机试剂任选)__________________
的路线。(用流程图表示,无机试剂任选)__________________
【答案】BD 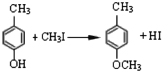 保护酚羟基,防止被氧化
保护酚羟基,防止被氧化 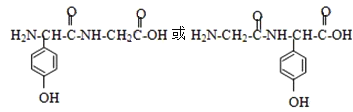
 (任写三个)
(任写三个) 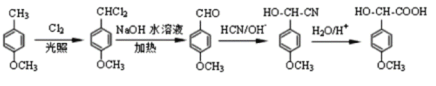
【解析】
(1)根据阿莫西林分子的结构可知分子式,官能团,手性碳的数目;
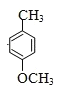
(2)根据①的生成物,推得反应物为对甲基苯酚,与CH3I发生取代反应,酚羟基很容易被氧化,加入CH3I防止被氧化;
(3)C的结构简式为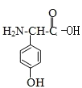 故形成二肽时,羧基失去羟基,氨基失去氢原子;
故形成二肽时,羧基失去羟基,氨基失去氢原子;
(4) 的同分异构体需满足分子式相同,结构不同的有机物,C的分子式为C8H9O3,满足条件①分子中含苯环,不含过氧键“-O-O-”;②分子中含有3种不同化学环境的氢原子,分子中可以含有一个硝基,两个甲基,一个羟基;或者两个甲基,两个羟基,一个氮氧双键;两个CH3O,一个氮氧双键,写出同分异构体的结构。
的同分异构体需满足分子式相同,结构不同的有机物,C的分子式为C8H9O3,满足条件①分子中含苯环,不含过氧键“-O-O-”;②分子中含有3种不同化学环境的氢原子,分子中可以含有一个硝基,两个甲基,一个羟基;或者两个甲基,两个羟基,一个氮氧双键;两个CH3O,一个氮氧双键,写出同分异构体的结构。
(5)  根据题中涉及的反应
根据题中涉及的反应![]()
![]()
![]() +H2O
+H2O
2.RCHO![]()
![]()
![]()
![]() 制备生成物的工艺流程为:苯环上的甲基转变为醛基,可由取代反应引入氯原子,二元氯代烃在碱性条件下发生取代反应得到含有醛基的有机物,加入氢氰酸,再加酸性条件下水解得到产物。
制备生成物的工艺流程为:苯环上的甲基转变为醛基,可由取代反应引入氯原子,二元氯代烃在碱性条件下发生取代反应得到含有醛基的有机物,加入氢氰酸,再加酸性条件下水解得到产物。
(1)A. 由结构简式可知, 阿莫西林的分子式为C16H19N3O5S,故A错误;
B. 连4个不同基团的原子为手性碳原子,则左侧与氨基,苯环,氢原子,羰基相连的碳原子,四元环上除羰基和氮原子外的两个碳原子均为手性碳,五元环中与羧基相连的碳原子为手性碳,故手性碳共4个,故B正确;
C. 酚OH具有酸性,能与NaOH发生中和反应,COOH能与NaOH发生中和反应,1mol分子中有2mol肽键,在碱性条件下可以水解,则1mol该物质最多可与4molNaOH反应,故B错误。
D. 含有羰基,可发生加成反应,含有苯环和羟基,可发生取代反应,酚羟基可发生氧化反应,含有氨基和羧基,可发生缩聚反应,故D正确;
故答案选BD;
(2)根据分析,A的结构简式为 反应方程式为
反应方程式为 ,酚羟基很容易被氧化,加入CH3I防止被氧化;
,酚羟基很容易被氧化,加入CH3I防止被氧化;
故答案为: ;保护酚羟基,防止被氧化;
;保护酚羟基,防止被氧化;
(3) C的结构简式为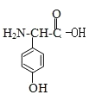 ,C和甘氨酸可以脱水缩合生成肽键,甘氨酸(H2N-CH2-COOH)和C发生缩合生成二肽的结构简式为:
,C和甘氨酸可以脱水缩合生成肽键,甘氨酸(H2N-CH2-COOH)和C发生缩合生成二肽的结构简式为: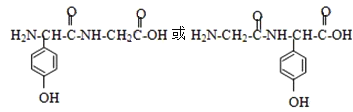 ,
,
故答案为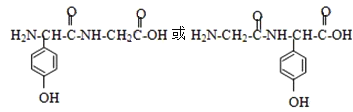 ;
;
(4)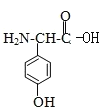 的同分异构体需满足分子式相同,结构不同的有机物,C的分子式为C8H9O3,满足条件①分子中含苯环,不含过氧键“-O-O-”;②分子中含有3种不同化学环境的氢原子,分子中可以含有一个硝基,两个甲基,一个羟基;或者两个甲基,两个羟基,一个氮氧双键;两个CH3O,一个氮氧双键,则符合要求的结构简式为:
的同分异构体需满足分子式相同,结构不同的有机物,C的分子式为C8H9O3,满足条件①分子中含苯环,不含过氧键“-O-O-”;②分子中含有3种不同化学环境的氢原子,分子中可以含有一个硝基,两个甲基,一个羟基;或者两个甲基,两个羟基,一个氮氧双键;两个CH3O,一个氮氧双键,则符合要求的结构简式为: ,
,
故答案为: (任写三个);
(任写三个);
(5)  根据题中涉及的反应
根据题中涉及的反应![]()
![]()
![]() +H2O
+H2O
2.RCHO![]()
![]()
![]()
![]() 制备生成物的工艺流程为:苯环上的甲基转变为醛基,可由取代反应引入氯原子,二元氯代烃在碱性条件下发生取代反应
制备生成物的工艺流程为:苯环上的甲基转变为醛基,可由取代反应引入氯原子,二元氯代烃在碱性条件下发生取代反应
得到含有醛基的有机物,加入氢氰酸,再加酸性条件下水解得到产物,则合成路线图如下: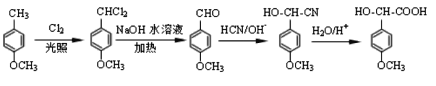 ,
,
故答案为: 。
。

【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
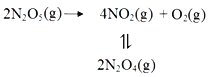
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4 kJ· mol-1
N2O4(g)![]() 2NO2(g) △H2=+55.3 kJ· mol-1
2NO2(g) △H2=+55.3 kJ· mol-1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的 △H=________kJ· mol-1。
O2(g)的 △H=________kJ· mol-1。
(2)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强介p∞(35℃)______63.1kPa(填“大于”“等于”或“小于”),原因是________________________________________________。
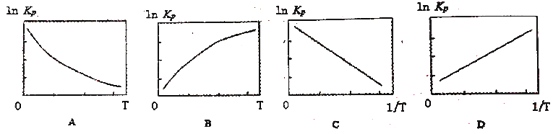
(3)25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
(4)邻二甲苯经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX)。某研究小组研究了采用N2O5为硝化剂时催化剂用量对该反应的影响。将一定量的催化剂和邻二甲苯置于反应瓶中,控制温度反应一定时间。测得邻二甲苯的转化率和3-NOX的选择性如图所示:
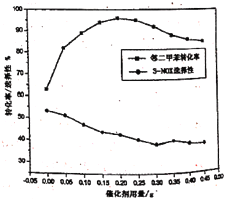
①描述并解释随着催化剂用量的增加,邻二甲苯转化率的变化趋势:____________。
②在图中画出4-NOX的选择性随催化剂用量变化的曲线_____________。
【题目】(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
① | 25 | 0.1 | 0.1 |
② | 25 | 0.2 | 0.1 |
③ | 25 | 0.1 | 0.2 |
④ | 50 | 0.2 | 0.1 |
⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________(填字母序号)。
A.硫酸钾