题目内容
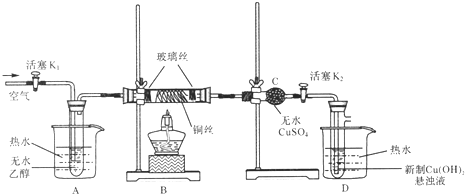
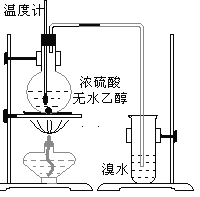
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
(1)写出甲同学实验中两个反应的化学方程式:_____________、___________________________。
(2)乙同学观察到的黑色物质是_____________,刺激性气体是_____________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
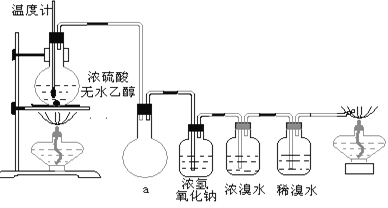
①设计装置a的作用是____________________
②浓溴水的作用是_______________________,稀溴水的作用是____________________。
【答案】CH3CH2OH ![]() CH2=CH2↑ + H2O CH2=CH2 + Br2
CH2=CH2↑ + H2O CH2=CH2 + Br2 ![]() Br-CH2CH2-Br C SO2 Br2 + SO2 + 2H2O = 2HBr + H2SO4 安全装置,防倒吸 吸收乙烯、二氧化硫气体 检验乙烯、二氧化硫气体是否除净
Br-CH2CH2-Br C SO2 Br2 + SO2 + 2H2O = 2HBr + H2SO4 安全装置,防倒吸 吸收乙烯、二氧化硫气体 检验乙烯、二氧化硫气体是否除净
【解析】
(1)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃;溴水中的溴与乙烯发生加成反应;
(2)浓硫酸具有强氧化性,能氧化乙醇;二氧化硫和溴发生氧化还原反应;
(3)①造成倒吸,是由于装置内的大气压与外面的大气压有一定的差值;
②浓溴水能和乙烯、二氧化硫反应。
(1)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH![]() CH2=CH2↑+H2O;溴水中的溴与乙烯发生加成反应,反应方程式:CH2=CH2+Br2→CH2BrCH2Br,
CH2=CH2↑+H2O;溴水中的溴与乙烯发生加成反应,反应方程式:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2+Br2→CH2BrCH2Br。
CH2=CH2↑+H2O;CH2=CH2+Br2→CH2BrCH2Br。
(2)乙同学仔细观察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,浓硫酸具有强氧化性,能氧化乙醇,把乙醇氧化成碳,同时自身被还原成二氧化硫;二氧化硫和溴发生氧化还原反应生成氢溴酸和硫酸:SO2+Br2+2H2O=H2SO4+2HBr,故答案为:C;SO2;SO2+Br2+2H2O=H2SO4 +2HBr。
(3)①乙烯易溶于溴水中,装置内的大气压与外面的大气压有一定的差值,设计装置a可防止浓溴水倒吸到制乙烯的反应容器中,故答案为:安全装置,防倒吸。
②溴水与二氧化硫发生氧化还原反应,溴被二氧化硫中+4价的硫还原成-1价的溴,+4价的硫被溴氧化成+6价的硫,溴水褪色;乙烯和溴水中的溴发生加成反应,溴水褪色,可检验乙烯的存在,二氧化硫和溴发生氧化还原反应生成氢溴酸和硫酸,可检验二氧化硫的存在,故答案为:吸收乙烯、二氧化硫气体;检验乙烯、二氧化硫是否除尽。

【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
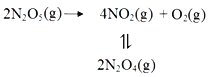
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4 kJ· mol-1
N2O4(g)![]() 2NO2(g) △H2=+55.3 kJ· mol-1
2NO2(g) △H2=+55.3 kJ· mol-1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的 △H=________kJ· mol-1。
O2(g)的 △H=________kJ· mol-1。
(2)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强介p∞(35℃)______63.1kPa(填“大于”“等于”或“小于”),原因是________________________________________________。
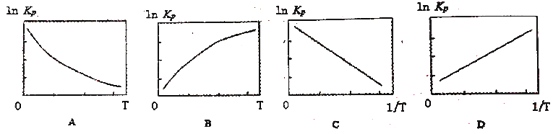
(3)25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
(4)邻二甲苯经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX)。某研究小组研究了采用N2O5为硝化剂时催化剂用量对该反应的影响。将一定量的催化剂和邻二甲苯置于反应瓶中,控制温度反应一定时间。测得邻二甲苯的转化率和3-NOX的选择性如图所示:
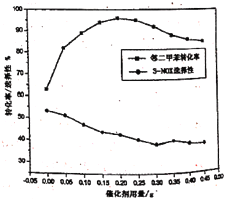
①描述并解释随着催化剂用量的增加,邻二甲苯转化率的变化趋势:____________。
②在图中画出4-NOX的选择性随催化剂用量变化的曲线_____________。
【题目】(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
① | 25 | 0.1 | 0.1 |
② | 25 | 0.2 | 0.1 |
③ | 25 | 0.1 | 0.2 |
④ | 50 | 0.2 | 0.1 |
⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________(填字母序号)。
A.硫酸钾