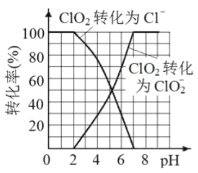
题目内容
【题目】有一烃A,能发生如图所示的一系列转化:
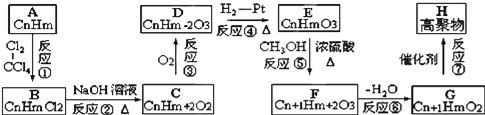
已知两个E分子间可发生缩合反应生成环状化合物C6H8O4,试解答下列问题:
(1)写出A和E的结构简式__、__。
(2)在反应①﹣⑦属于取代反应的有__。
(3)写出下列反应的化学方程式:
反应①__。
反应④__。
反应⑦__。
【答案】CH3CH=CH2 CH3CH(OH)COOH ②⑤ CH3CH=CH2+Cl2![]() CH3CHClCH2Cl
CH3CHClCH2Cl ![]() +H2
+H2![]() CH3CH(OH)COOH nCH2=CHCOOCH3
CH3CH(OH)COOH nCH2=CHCOOCH3![]()
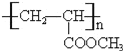
【解析】
A与氯气反应生成B,由A、B的分子式可知,为加成反应,故A烯烃,B发生水解反应生成C为醇,C发生氧化反应生成D,由H原子数目、及氧原子数目变化可知,应是﹣OH氧化为羰基、﹣COOH,D与氢气发生加成反应生成E,应是羰基被还原为﹣OH,E分子中含有1个﹣OH、1个﹣COOH,两个E分子间可发生缩合反应生成环状化合物C6H8O4,应是脱去2分子水发生酯化反应形成的环酯,故E的分子式为C3H6O3,结合D中含有羰基,故E为CH3CH(OH)COOH,逆推可得,D为![]() 、C为CH3CH(OH)CH2OH、B为CH3CHClCH2Cl、A为CH3CH=CH2.E与甲醇发生酯化反应生成F为CH3CH(OH)COOCH3,F发生消去反应生成G为CH2=CHCOOCH3,G发生加聚反应生成高聚物H为
、C为CH3CH(OH)CH2OH、B为CH3CHClCH2Cl、A为CH3CH=CH2.E与甲醇发生酯化反应生成F为CH3CH(OH)COOCH3,F发生消去反应生成G为CH2=CHCOOCH3,G发生加聚反应生成高聚物H为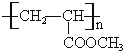 ,据此解答。
,据此解答。
(1)由上述分析可知,A为CH3CH=CH2,E为CH3CH(OH)COOH;
(2)反应①④属于加成反应,反应②⑤属于取代反应,反应③属于氧化反应,反应⑥属于消去反应,反应⑦属于加聚反应;
(3)反应①的方程式为:CH3CH=CH2+Cl2 ![]() CH3CHClCH2Cl;
CH3CHClCH2Cl;
反应④的方程式为:![]() +H2
+H2![]() CH3CH(OH)COOH;
CH3CH(OH)COOH;
反应⑦的方程式为:nCH2=CHCOOCH3![]()
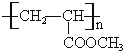 。
。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案