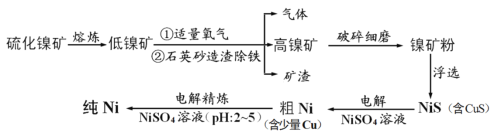
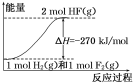
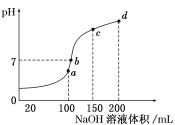
题目内容
【题目】按照要求回答下列问题
(1)硫酸铁溶液显酸性的原因_____(用离子方程式表示).
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合溶液中c(CH3COO﹣)=c(Na+),则混合后溶液显_____性.
(3)浓度均为0.1mol/L①氯化铵②醋酸铵③硫酸氢铵④氨水四种溶液中,c(NH4+)由大到小的顺序_____(填序号).
(4)将化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)B(g)+nC(g),反应到3min时,容器内A的浓度为0.8mol/L,测得这段时间内,平均速率ν(C)=0.6mol/(Lmin),则化学方程式中的n值为_____,ν(B)=_____,此时A的分解率为_____.
【答案】Fe3++3H2O ![]() Fe(OH)3+3H+ 中 ③①②④ 3 0.2 mol/(L·min) 60%
Fe(OH)3+3H+ 中 ③①②④ 3 0.2 mol/(L·min) 60%
【解析】
(1)硫酸铁溶液中,Fe3+发生水解,溶液显酸性;
(2)根据电荷守恒进行分析;
(3)从盐类的水解和弱电解质的电离程度微弱进行分析;
(4)根据化学反应速率以及物质的量在反应方程式的应用进行分析;
(1)硫酸铁属于强酸弱碱盐,Fe3+发生水解:Fe3++3H2O ![]() Fe(OH)3+3H+,使溶液中c(H+)>c(OH-),溶液显酸性;
Fe(OH)3+3H+,使溶液中c(H+)>c(OH-),溶液显酸性;
(2)根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),因为c(Na+)=c(CH3COO-),因此有c(H+)=c(OH-),溶液显中性;
(3)盐类水解程度和弱电解质的电离程度都是微弱,因此四种溶液中NH3·H2O中的c(NH4+)最小,硫酸氢铵溶液中存在大量H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,相互促进水解,盐中c(NH4+)最小,因此c(NH4+)由大到小的顺序是③①②④;
(4)根据化学反应速率的数学表达式,这段时间内生成C的物质的量浓度为0.6mol/(L·min)×3min=1.8mol/L,根据反应方程式,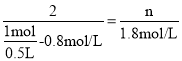 ,解得n=3,根据反应速率之比等于化学计量数之比,因此有v(B)=
,解得n=3,根据反应速率之比等于化学计量数之比,因此有v(B)=![]() v(C)=
v(C)=![]() ×0.6 mol/(L·min)=0.2 mol/(L·min),0-3min消耗A的物质的量为(1mol-0.8mol/L×0.5L)=0.6mol,则A的分解率=
×0.6 mol/(L·min)=0.2 mol/(L·min),0-3min消耗A的物质的量为(1mol-0.8mol/L×0.5L)=0.6mol,则A的分解率=![]() ×100%=60%。
×100%=60%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案