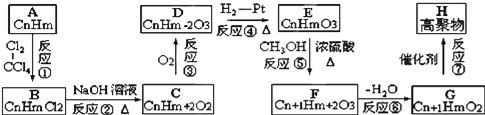
题目内容
【题目】电气石是一种具有保健作用的天然石材,其中含有的主要元素为B、Si、Al、Mg、Na、O等元素。
(1)上述元素中,原子半径最小的是_________(用元素符号表示),在元素周期表中处于金属和非金属分界线附近的元素是_____________(用元素符号表示);
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式,从中选择最详尽描述核外电子运动状态的方式,来表示氧元素原子核外电子的运动状态______________;
(3)B与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B—F键的键长相等,三根键的键角相等,能否仅仅依据此数据此判断BF3分子的极性____________;
(4)SiO2晶体的熔点比BF3晶体________(选填“高”、“低”)。
【答案】O B、Si、Al ![]() 非极性 高
非极性 高
【解析】
(1)同周期自左而右原子半径减小,电子层越多原子半径越大;在元素周期表中处于金属和非金属分界线附近的元素是B、Si、Al;
(2)最详尽描述核外电子运动状态的方式为核外电子轨道排布式,根据核外电子排布规律画出;处于不同能级的电子,能量不同,处于同一能级不同轨道的电子能量相同;
(3)BF3分子中三根B﹣F键的键长相等且键角也相等,为平面正三角形结构,正负电荷重心重合;根据晶体类型判断熔点高低,一般熔点:原子晶体>离子晶体>分子晶体;
(4)BF3是分子晶体,SiO2是原子晶体。
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Na>Mg>Al>Si>B>O,在元素周期表中处于金属和非金属分界线附近的元素是B、Si、Al;
(2)最详尽描述核外电子运动状态的方式为核外电子轨道排布式,氧元素原子核外电子轨道排布式为:![]() ;
;
(3)BF3分子中三根B﹣F键的键长相等且键角也相等,为平面正三角形结构,正负电荷重心重合,为非极性分子;
(4)BF3是分子晶体,SiO2是原子晶体,故SiO2晶体的熔点比BF3晶体高。