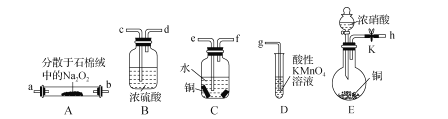
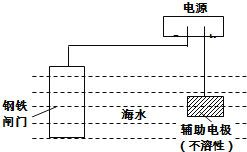
��Ŀ����
����Ŀ����������(ClO2)��һ����ˮ�����ȷ����й㷺Ӧ�õĸ�Ч��ȫ��������������Cl2��Ȳ��������������DZ��Σ�����л��ȴ����֪: ClO2Ũ�ȹ��������ֽ⣬�����ᱬը�����������Ʊ�ClO2�ķ���:
��1������һ��������
�����������ƺ�ϡ����Ϊԭ���Ʊ�����Ӧԭ��Ϊ5NaClO2+4HCl=5NaCl+4ClO2��+2H2O��
�ٸ÷�Ӧ���������ͻ�ԭ�������ʵ���֮����_______________________��
���о�����������Ӧ��ʼʱ����Ũ�Ƚϴ��������������Cl2�������ӷ���ʽ���Ͳ���Cl2��ԭ��__________________________________________________��
��2�������������ỹԭ��
��������Һ���ò��ᣨH2C2O4����ԭ�����Ƶķ������Ʊ�ClO2
��д���Ʊ�ClO2�����ӷ���ʽ��__________________________________________��
�����ⷨ��ȣ��ò��ỹԭ���Ʊ�ClO2���ص���____________________����������������漰������̵İ�ȫ�ԡ�
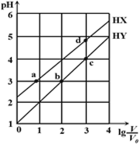
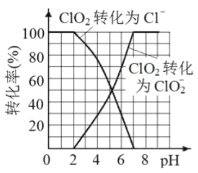
��3����֪: ClO2��I-��ԭΪClO2-��Cl-��ת��������ҺpH �Ĺ�ϵ��ͼ��ʾ����pH<2.0 ʱ��ClO2-Ҳ�ܱ�I- ��ȫ��ԭΪCl-����Ӧ���ɵ�I2��Na2S2O3 ��Ӧ�ķ���ʽ: 2Na2S2O3+ I2= Na2S4O6 + 2NaI����ClO2����������ˮ�к���ClO2��ClO2-���ⶨ����ˮ��ClO2��ClO2-�ĺ���������������:
��������ֹ��ȷ����ˮ����ClO2�ĺ���Ϊa mol/L��
���õζ�������ClO2-�ĺ������������Ӧ��ʵ�鲽��:
����1: ȷ��ȡV mL ����ˮ��������ƿ�С�
����2: ����ˮ����pHС��2��
����3: ����������KI ���壬��ַ�Ӧ��
����4: ��������������Һ����c mol/L Na2S2O3 ��Һ�ζ����յ㣬����Na2S2O3 ��ҺV1 mL��
���������������ݣ���ø�����ˮ��ClO2-��Ũ��Ϊ___________mol/L( �ú���ĸ�Ĵ���ʽ��ʾ)��
���𰸡�1��4 4H++ClO2-+3Cl-=2Cl2��+2H2O 2ClO3 - + H2C2O4+ 2H+ =2ClO2�� + 2CO2�� + 2H2O ���ɵ�CO2��ClO2��ϡ������ ![]()
��������
(1)5NaClO2+4HCl�T5NaCl+4ClO2��+2H2O�У�ClԪ�صĻ��ϼ���+3����Ϊ-1�ۣ�+3������Ϊ+4�ۣ���1molNaClO2�õ�������4molNaClO2ʧȥ������ȣ�
�ڷ�Ӧ��ʼʱ����Ũ�Ƚϴ��������������Cl2������������ԭ��Ӧ��
(2) ����������Һ���ò��ᣨH2C2O4����ԭ�����Ƶķ������Ʊ�ClO2ʱ��ͬʱ�������ɶ�����̼��ˮ��
�ڵ�ⷨ������ClO2Ũ�ȹ��ߣ���ClO2Ũ�ȹ��������ֽ⣬�����ᱬը���ݴ˷�����
(3)����4��Na2S2O3�ζ���Һ��I2������2��Ҫ����pHʹClO2��I����ΪI2���ɵ���ת���غ�ɵã�2ClO25I2������ClO2��������I2�����ʵ���������2Na2S2O3+I2=Na2S4O6+2NaI��������Һ��I2�����ʵ������ټ���ClO2�������ɵ�I2�����ʵ������ɵ���ת���غ�ɵã�ClO22I2������ClO2�����ʵ���������������Ũ�ȡ�
(1)��1mol NaClO2�õ�������4mol NaClO2ʧȥ������ȣ���÷�Ӧ���������ͻ�ԭ�������ʵ���֮����1:4���ʴ�Ϊ��1:4��
������Ӧ��ʼʱ����Ũ�Ƚϴ��������������Cl2�������ӷ���ʽ���Ͳ���Cl2��ԭ��Ϊ4H++ClO2-+3Cl-=2Cl2��+2H2O���ʴ�Ϊ��4H++ClO2-+3Cl-=2Cl2��+2H2O��
(2) ����������Һ���ò��ᣨH2C2O4����ԭ�����Ƶķ������Ʊ�ClO2ʱ��ͬʱ�������ɶ�����̼��ˮ�����ӷ���ʽΪ��2ClO3 - + H2C2O4+ 2H+ =2ClO2�� + 2CO2�� + 2H2O���ʴ�Ϊ��2ClO3 - + H2C2O4+ 2H+ =2ClO2�� + 2CO2�� + 2H2O��
�ڵ�ⷨ������ClO2Ũ�ȹ��ߣ���ClO2Ũ�ȹ��������ֽ⣬�����ᱬը�����ò��ỹԭ���Ʊ�ClO2ʱ�����ɵ�CO2��ClO2��ϡ�����ã������������ȫ�ԣ��ʴ�Ϊ�����ɵ�CO2��ClO2��ϡ�����ã�
(3) VmL��Һ�У�ClO2�����ʵ���Ϊ=V��103L��amol/L=aV��103mol���ɵ���ת���غ�ɵã�2ClO25I2��ClO2��������I2�����ʵ���=2.5aV��103mol������Na2S2O3�����ʵ���=V1��103L��cmol/L=cV1��103mol����2Na2S2O3+I2=Na2S4O6+2NaI����Һ��I2�����ʵ���=0.5cV1��103mol��ClO2�������ɵ�I2�����ʵ���=0.5cV1��103mol2.5aV��103mol=(0.5cV12.5aV)��103mol���ɵ���ת���غ�ɵã�ClO22I2����ClO2�����ʵ���=![]() ��(0.5cV12.5aV)��103mol����
��(0.5cV12.5aV)��103mol����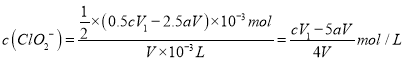 ��
��
�ʴ�Ϊ��![]() ��
��

����Ŀ��������ʵ������һ���ܵó���Ӧ���۵���
ѡ�� | A | B | C | D |
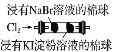
װ�û���� | ȡ��֧�Թܸ�����4 mL 0.01 mol/L�IJ�����Һ���ֱ�μ�2 mL 0.1 mol/L��0.2 mol/L�ĸ��������Һ |
|
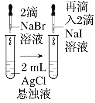
| ��ֱ�ʢ��5 mL 0.1 mol/L�������������Һ���Թ��еμ�5 mL 0.1 mo/L��������Һ��һ��ʱ��ֱ������ˮ����ˮ�С� |
���� | ��ɫ���۲���ɫ��ʱ�� | ��������ƣ��ұ�������� | �Թ����ȳ��ֵ���ɫ���壬����ֻ�ɫ���� | �Թ���Һ����������ˮ�����ȳ��ֻ��� |
���� | ������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�� | �����ԣ�Cl2>Br2>I2 | �ܽ�ȣ�AgCl>AgBr>AgI | ����˵���¶�Խ�ߣ�����Խ�� |
A.AB.BC.CD.D