题目内容
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)第三周期元素的原子所形成的简单离子中:半径最大的阴离子是__;氧化性最强的阳离子是__.
(2)下列事实可以作为S和Cl非金属性强弱的判断依据的是__(选填序号)
a.Cl的最高正价比S高 b.可用浓H2SO4制HCl
c.HCl的酸性比H2S强 d.Cl2与H2S反应生成S.
(3)硅元素最外层有__种能量不同的电子;SiCl4的空间构型和CH4相同,写出SiCl4的电子式:__.
(4)PH3和NH3的某些化学性质相似.下列对晶体PH4I性质的推测,错误的是__(选填序号)
a.PH4I是一种共价化合物 b.PH4I能与烧碱溶液反应
c.PH4I加热后会发生升华 d.PH4I溶液能与溴水反应.
(5)二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似.下列有关说法不正确的是__(选填序号)
a.S2C12分子中有4对共用电子对
b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为﹣1价
d.S2C12分子中各原子均为8电子稳定结构.
【答案】P3﹣ Al3+ d 2 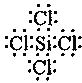 ac ab
ac ab
【解析】
(1)同周期中元素原子半径依次减小,稀有气体除外,形成的简单离子,先看电子层,再看核电荷数分析比较,元素对应的单质还原性越弱,对应离子氧化性越强;
(2)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断;
(3)硅元素最外层有4个电子,外围电子排布3s23p2,所以有2 种能量不同的电子;SiCl4的空间构型和CH4相同,所以硅与四个氯形成四对共用电子对;
(4)a.PH4I类似NH4Cl是离子化合物;b.NH4Cl能与碱反应,所以PH4I能与烧碱溶液反应;c.PH4I加热后会发生PH4I![]() PH3↑+I2+H2↑;d.PH4I溶液中的碘离子能与溴水中的单质溴置换反应;
PH3↑+I2+H2↑;d.PH4I溶液中的碘离子能与溴水中的单质溴置换反应;
(5)S2C12的分子结构与H2O2相似,所以S2C12的分子结构与H2O2相似,所以分子中有4对共用电子对,S2C12分子中有硫硫非极性,S2C12分子中,S为+1价,Cl为﹣1,S2C12分子中各原子均为8电子稳定结构。
(1)同周期中元素原子半径依次减小,稀有气体除外,形成的简单离子,先看电子层,再看核电荷数,第三周期元素中形成简单的阴离子为P3﹣、S2﹣、Cl﹣,电子层数相同,核电荷数越大,半径越小,则半径最大的阴离子是P3﹣,元素对应的单质还原性越弱,对应离子氧化性越强,所以最强的是铝离子,故答案为:P3﹣,Al3+;
(2)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度分析,
a、Cl的最高正价比S高,不能通过化合价来判断非金属性强弱,故a错误;
b、可用浓H2SO4制HCl,是利用不挥发性的酸来制备挥发性的酸,故b错误;
c、HCl的酸性比H2S强,不是最高价含氧酸的酸性,故c错误;
d、Cl2与H2S反应生成S,氯的非金属性强于硫,故d正确;
答案选d;
(3)硅元素最外层有4个电子,外围电子排布3s23p2,所以有2 种能量不同的电子;SiCl4的空间构型和CH4相同,所以硅与四个氯形成四对共用电子对,电子式为: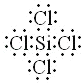 ,故答案为:2;
,故答案为:2; ;
;
(4)a.PH4I类似NH4Cl是离子化合物,故a错误;
b.NH4Cl能与碱反应,所以PH4I能与烧碱溶液反应,故正b确;
c.PH4I加热后会发生PH4I![]() PH3↑+I2+H2↑,发生分解而不是升华,故c错误;
PH3↑+I2+H2↑,发生分解而不是升华,故c错误;
d.PH4I溶液中的碘离子能与溴水中的单质溴置换反应,故d正确;故选ac,故答案为:ac;
(5)S2C12的分子结构与H2O2相似,所以S2C12的分子结构与H2O2相似,结构式为Cl﹣S﹣S﹣Cl,所以分子中有3对共用电子对,S2C12分子中有硫硫非极性,S2C12分子中,S为+1价,Cl为﹣1,S2C12分子中各原子均为8电子稳定结构,故选ab,故答案为:ab。

 轻松夺冠全能掌控卷系列答案
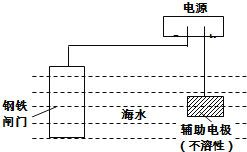
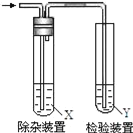
轻松夺冠全能掌控卷系列答案【题目】欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
小组 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4 |
A.AB.BC.CD.D