题目内容
6.长效阿司匹林的结构为: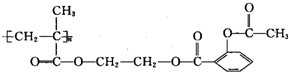 ,1mol该物质能与NaOH反应的物质的量是( )
,1mol该物质能与NaOH反应的物质的量是( )| A. | 3mol | B. | 4mol | C. | 3n mol | D. | 4n mol |
分析 有机物为高聚物,含有3n个酯基,可水解生成的羧基、酚羟基可与氢氧化钠反应,以此解答该题.
解答 解:1mol有机物可水解生成3nmol羧基和nmol酚羟基,则可与4nmolNaOH发生反应.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,把握羧基、酯、苯酚的性质即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.用NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数是2NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA |
17. 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
(1)写出圆底烧瓶内发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(2)分液漏斗和圆底烧瓶之间的导管a的作用是保证烧瓶和漏斗内压强恒定,有利于漏斗中的液体滴入锥形瓶中,b的作用是防止锥形瓶中的溶液倒吸.
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号)BD.
A.锥形瓶水洗后未烘干 B.滴定过程中滴定管有漏水现象
C.滴定过程中有少量溶液从锥形瓶中溅出 D.滴定前滴定管内有气泡,滴定后没有了
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是仍有氨气残留在装置中未被锥形瓶中的硫酸吸收.
(5)利用题目中所给数据计算肥料中总氮含量为28.6%(计算结果保留到小数点后1位).
 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:| 实验 次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5.22 |
| 2 | 6.00 | 11.18 |
| 3 | 12.00 | 17.20 |
(2)分液漏斗和圆底烧瓶之间的导管a的作用是保证烧瓶和漏斗内压强恒定,有利于漏斗中的液体滴入锥形瓶中,b的作用是防止锥形瓶中的溶液倒吸.
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号)BD.
A.锥形瓶水洗后未烘干 B.滴定过程中滴定管有漏水现象
C.滴定过程中有少量溶液从锥形瓶中溅出 D.滴定前滴定管内有气泡,滴定后没有了
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是仍有氨气残留在装置中未被锥形瓶中的硫酸吸收.
(5)利用题目中所给数据计算肥料中总氮含量为28.6%(计算结果保留到小数点后1位).
11.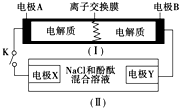 下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )
下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )
 下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )
下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )| A. | K+从左到右通过离子交换膜 | |
| B. | 电极A上发生的反应为:3I--2e-═I3- | |
| C. | 电极X上发生的反应为:2Cl--2e-═Cl2↑ | |
| D. | 当有0.1 mol K+通过离子交换膜,X电极上产生1.12 L气体 |
15.能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中加入CH3COONa晶体 | D. | 向水中加入NH4Cl溶液 |
16.下表是元素周期表中短周期元素部分,表中字母分别代表一种元素:
(1)上述化学性质最不活泼的元素是氦(填元素名称).
(2)画出h的原子结构示意图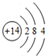 ,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)c、d、g离子半径由小到大的顺序是O2->Na+>Al3+ (用离子符号表示).
(4)表中元素g的氢化物稳定性>(填“>”或“<”)元素e的氢化物稳定性.
(5)c元素最高价氧化物的水化物中含有离子键、共价键(填化学键类型),该物质不能储存在带玻璃塞的试剂瓶中的原因:SiO2+2NaOH=Na2SiO3+H2O(用化学方程式表示).
| a | b | ||||||
| e | f | g | |||||
| c | d | h | i | j | |||
(2)画出h的原子结构示意图
 ,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.(3)c、d、g离子半径由小到大的顺序是O2->Na+>Al3+ (用离子符号表示).
(4)表中元素g的氢化物稳定性>(填“>”或“<”)元素e的氢化物稳定性.
(5)c元素最高价氧化物的水化物中含有离子键、共价键(填化学键类型),该物质不能储存在带玻璃塞的试剂瓶中的原因:SiO2+2NaOH=Na2SiO3+H2O(用化学方程式表示).
 .
.