题目内容
6.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中: Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中: 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸溶液中加入NaOH溶液至中性:H++OH-═H2O | 向稀H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-═H2O |
| C | 向有水垢的瓶胆内加入足量稀盐酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O | 向有水垢的瓶胆内加入足量醋酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 向Ca(OH)2溶液中通入过量CO2: CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2: SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.金属铁可以将金属铜从其盐中置换出来,但是活泼金属钠和盐的反应一定是和盐中的水反应;
B.硫酸和氢氧化钡反应生成水和硫酸钡沉淀;
C.稀盐酸为强酸,醋酸为弱酸,醋酸在离子方程式中需要保留分子式;
D.二氧化碳和二氧化硫均能使澄清的石灰水变浑浊.
解答 解:A.铁排在金属铜的前面,金属铁可以将金属铜从其盐中置换出来,但是活泼金属钠和盐的反应是先和盐中的水反应,不会置换出其中的金属,反应的离子方程式为:2Na+2H2O+Cu2+═2Na++Cu(OH)2↓+H2↑,两个反应不能类推,故A错误;
B.硫酸和氢氧化钡反应生成水和硫酸钡沉淀,离子反应方程式为:Ba2++2H++2OH-+SO42-=2H2O+BaSO4↓,稀硫酸与NaOH溶液的离子方程式为:H++OH-=H2O,两个反应的离子方程式不同,不能类推,故B错误;
C.水垢的主要成分为碳酸钙,碳酸钙与醋酸的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-、与盐酸的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,两个反应的离子方程式不同,不能类推,故C错误;
D.二氧化碳和二氧化硫均能使澄清的石灰水变浑浊,如果气体过量会变澄清,碳酸钙和亚硫酸钙均是难溶于水的盐,碳酸氢钙和亚硫酸氢钙是易溶于水的,可以类推,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,本题中明确反应实质为解答关键.

练习册系列答案
相关题目
16.下列关于同分异构体的说法正确的是( )
| A. | 分子式和结构都相同,性质可能相同 | |
| B. | 分子式相同,结构不同,化学性质一定不相同 | |
| C. | 相对分子质量一定相同、官能团一定不同 | |
| D. | 相对分子质量和各元素质量分数一定相同,化学性质不一定相同 |
17.下列表示物质结构的化学用语正确的是( )
| A. | 8个中子的碳原子的核素符号:14C | B. | HF的电子式: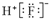 | ||
| C. | Cl-离子的结构示意图: | D. | 氧化铝的化学式:AlO |
14.现有部分短周期元素的性质或原子结构如下表:
(1)元素T的阴离子的结构示意图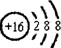 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其氢化物的空间构型为正四面体 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
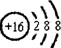 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
15.用NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数是2NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA |
17.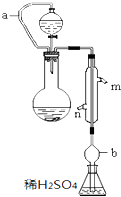 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
(1)写出圆底烧瓶内发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(2)分液漏斗和圆底烧瓶之间的导管a的作用是保证烧瓶和漏斗内压强恒定,有利于漏斗中的液体滴入锥形瓶中,b的作用是防止锥形瓶中的溶液倒吸.
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号)BD.
A.锥形瓶水洗后未烘干 B.滴定过程中滴定管有漏水现象
C.滴定过程中有少量溶液从锥形瓶中溅出 D.滴定前滴定管内有气泡,滴定后没有了
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是仍有氨气残留在装置中未被锥形瓶中的硫酸吸收.
(5)利用题目中所给数据计算肥料中总氮含量为28.6%(计算结果保留到小数点后1位).
 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:| 实验 次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5.22 |
| 2 | 6.00 | 11.18 |
| 3 | 12.00 | 17.20 |
(2)分液漏斗和圆底烧瓶之间的导管a的作用是保证烧瓶和漏斗内压强恒定,有利于漏斗中的液体滴入锥形瓶中,b的作用是防止锥形瓶中的溶液倒吸.
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号)BD.
A.锥形瓶水洗后未烘干 B.滴定过程中滴定管有漏水现象
C.滴定过程中有少量溶液从锥形瓶中溅出 D.滴定前滴定管内有气泡,滴定后没有了
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是仍有氨气残留在装置中未被锥形瓶中的硫酸吸收.
(5)利用题目中所给数据计算肥料中总氮含量为28.6%(计算结果保留到小数点后1位).
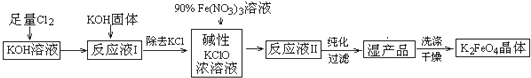
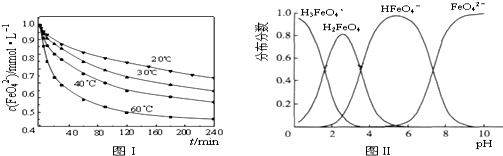
 元素及其化合物的学习和应用是中学化学的主要任务之一.
元素及其化合物的学习和应用是中学化学的主要任务之一.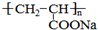 )是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图:
)是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图: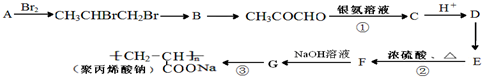
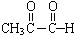 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$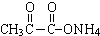 +3NH3+2Ag↓+H2O.
+3NH3+2Ag↓+H2O.