题目内容
19.将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 4.0 mol SO2+1.0 mol O2 | |
| C. | 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 | |
| D. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
分析 开始投入2.0mol SO2气体和2.0mol SO3气体,等效为开始投入4.0mol SO2气体和1mol O2气体,在恒温恒容下,平衡时SO3的物质的量为n mol,说明应是完全等效平衡,按化学计量转化到左边,对应成分的物质的量相同,即满足4.0mol SO2气体和1mol O2气体,据此判断.
解答 解:开始投入2.0mol SO2气体和2.0mol SO3气体,等效为开始投入4.0mol SO2气体和1mol O2气体,在恒温恒容下,平衡时SO3的物质的量为n mol,说明应是完全等效平衡,按化学计量转化到左边,对应成分的物质的量相同,即满足4.0mol SO2气体和1mol O2气体.
A、开始为1.6 mol SO2+0.3 mol O2+0.4 mol SO3,转化到左边,由2SO2(g)+O2(g)?2SO3(g)可知,n(SO2)=1.6mol+0.4 mol=2mol,n(O2)=0.3mol+$\frac{1}{2}$×0.4mol=0.5mol,不满足4.0mol SO2气体和1mol O2气体,故A错误;
B、开始为4.0 mol SO2+1.0 mol O2,与原平衡等效,故B正确;
C、开始为2.0 mol SO2+1.0 mol O2+2.0 mol SO3,转化到左边,由2SO2(g)+O2(g)?2SO3(g)可知,n(SO2)=2mol+2 mol=4mol,n(O2)=1mol+$\frac{1}{2}$×2mol=2mol,不满足4.0molSO2气体和1molO2气体,故C错误;
D、开始为3.0 mol SO2+1.0 mol O2+1.0 mol SO3,转化到左边,由2SO2(g)+O2(g)?2SO3(g)可知,n(SO2)=3mol+1 mol=4mol,n(O2)=0.5mol+1mol=1.5mol,不满足4.0molSO2气体和1molO2气体,故D错误.
故选B.
点评 本题考查化学平衡计算、等效平衡等,难度中等,清楚等效平衡规律是解题的关键.

| A. | 1:4 | B. | 1:2 | C. | 3:4 | D. | 3:2 |
| A. | ① | B. | 仅② | C. | ①②③ | D. | ②③④ |
| A. | 锂与氧气反应时,反应条件不同产物不同 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 合金的熔点比其成分金属的熔点低,所以钾钠合金可以做原子反应堆的导热剂 | |
| D. | 合金中至少含两种金属 |
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
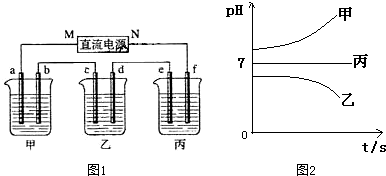
(1)M为电源的负极(填写“正”或“负”),甲电解质为NaCl(填化学式).
(2)计算电极f上生成的气体在标准状况下的体积:1.4L.
(3)写出乙烧杯的电解池反应4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为25L,则该溶液的pH为12.
(5)要使丙恢复到原来的状态,应加入2.25 gH2O.(填写化学式)
| A. | a=b | B. | a=2b | C. | a/2<b<a | D. | a>2b |
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 甲苯与浓硝酸和浓硫酸的混合物反应: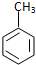 +3HNO3$→_{△}^{浓H_{2}SO_{4}}$ +3HNO3$→_{△}^{浓H_{2}SO_{4}}$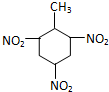 +3H2O +3H2O | |
| D. | 实验室用液溴和苯制溴苯: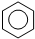 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$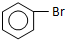 +HBr +HBr |
 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.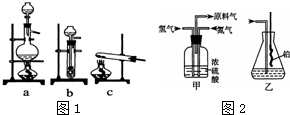
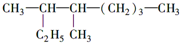 的名称是3,4一二甲基辛烷,
的名称是3,4一二甲基辛烷, ,1mol该烃完全燃烧需消耗氧气18.5mol,
,1mol该烃完全燃烧需消耗氧气18.5mol,