题目内容
7.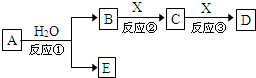 由短周期元素组成的中学常见物质A、B、C、D、E存在图转化关系(部分生成物和反应条件略).
由短周期元素组成的中学常见物质A、B、C、D、E存在图转化关系(部分生成物和反应条件略).(1)若A为氧化物,其焰色反应显黄色,X为空气成分,B、C、D溶液均显碱性,D的用途之一为发酵粉或治疗胃酸过多等.
(2)若反应①为通电电解,是重要的工业反应之一,X是生产生活中使用最广泛的金属,B为有色气体单质,反应①的化学反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)若A由两种元素构成,其一为第三周期元素;B为能使湿润的红色石蕊试纸变蓝色的气体,E为白色沉淀,B、E都能使酚酞试液变红,则反应①的化学反应方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
(4)若A分子含有4个碳原子,不溶于水,D、E是同种有机物,75%B的水溶液(体积比) 常用于医疗消毒,X为气态单质,反应②需催化,反应②的化学反应方程式为2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O.
分析 (1)若A为氧化物,其焰色反应显黄色,说明含有钠元素,可能为氧化钠或过氧化钠,但与水反应生成两种物质,则A为Na2O2,E为O2,B为NaOH,X为空气成分,B、C、D溶液均显碱性,则X为CO2,C为Na2CO3,D为NaHCO3;
(2)若反应①为通电电解,是重要的工业反应之一,且在水溶液中进行,一般为氯碱工业,A为NaCl,B为有色气体单质,应为Cl2,X是生产生活中使用最广泛的金属,由转化关系可知存在变价,应为Fe,则C为FeCl3,D为FeCl2;
(3)B、E都能使酚酞试液变红,B、E为碱性物质,A由两种元素构成,与水反应生成B和E,B为气体,E为白色沉淀,则A氮化镁,B为氨气,E为氢氧化镁;
(4)75% B的水溶液常用于医疗消毒,则B为乙醇,A分子含有4个碳原子,D、E是同种有机物,则A为乙酸乙酯.
解答 解:(1)若A为氧化物,其焰色反应显黄色,说明含有钠元素,可能为氧化钠或过氧化钠,但与水反应生成两种物质,则A为Na2O2,E为O2,B为NaOH,X为空气成分,B、C、D溶液均显碱性,则X为CO2,C为Na2CO3,D为NaHCO3,NaHCO3常用作为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂,
故答案为:发酵粉或治疗胃酸过多等;
(2)若反应①为通电电解,是重要的工业反应之一,且在水溶液中进行,一般为氯碱工业,A为NaCl,B为有色气体单质,应为Cl2,X是生产生活中使用最广泛的金属,由转化关系可知存在变价,应为Fe,则C为FeCl3,D为FeCl2,反应①为电解氯化钠溶液的反应,方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)B、E都能使酚酞试液变红,B、E为碱性物质,A由两种元素构成,与水反应生成B和E,B为气体,E为白色沉淀,则A氮化镁,B为氨气,E为氢氧化镁,反应①的化学反应方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,
故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(4)75% B的水溶液常用于医疗消毒,则B为乙醇,A分子含有4个碳原子,D、E是同种有机物,则A为乙酸乙酯,反应②的化学反应方程式为2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O.
点评 本题考查无机物的推断,是高考中的常见题型,试题综合性强,难度较大,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生分析问题、以及灵活运用基础知识解决实际问题的能力.做好本题的关键之处在于把握好常见物质的性质以及有关转化,并能结合题意具体问题、具体分析即可.

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | NaOH溶液于水时仅破坏了离子键而未破坏共价键 | |
| B. | NH4Cl溶解于水时不仅破坏了离子键还破坏了共价键 | |
| C. | H2SO4溶解于水时,所有的共价键都被破坏 | |
| D. | HCl溶解于水时电离出H+和Cl-,所以共价键变成了离子键 |
CH3OH (g)+H2O (g)?CO2(g)+3H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示.
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
H2(g)+O2(g)?H2 O(g)△H2=-120.9kJ/mol K2
则甲醇与水蒸气催化重整反应的焓变△H3=-72.0kJ/mol.
(2)10~30 min内,氢气的平均反应速率v(H2)=0.06mol/(L•min).
(3)该反应的平衡常数表达式为K=$\frac{{K}_{1}}{{K}_{2}}$.
(4)下列措施中能使平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$)减小的是(双选)CD.
A.加入催化剂
B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离
D.再充入1molH2O.
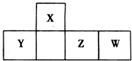 短周期元素X、Y、Z、W在周期表中的相对位置如图,X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐.下列判断错误的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐.下列判断错误的是( )| A. | 最简单气态氢化物的稳定性:X>Y | |
| B. | 单核阴离子半径:Z>W | |
| C. | 含Z元素的盐溶液可能显酸性、碱性或中性 | |
| D. | W元素的单质具有漂白性,常用于自来水的杀菌消毒 |
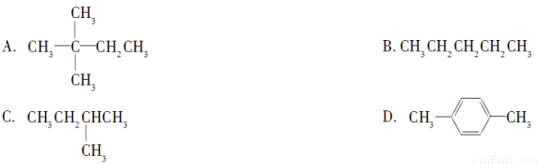
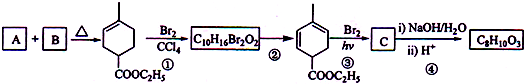
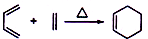
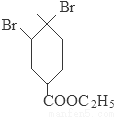 +2NaOH
+2NaOH
 +2NaBr+2H2O;
+2NaBr+2H2O;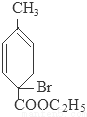 +2H2O
+2H2O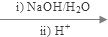
 +C2H5OH+HBr:
+C2H5OH+HBr: .
.
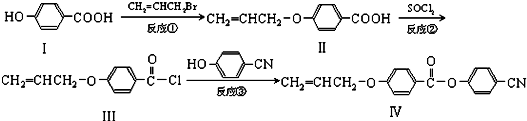
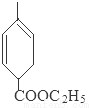
 .
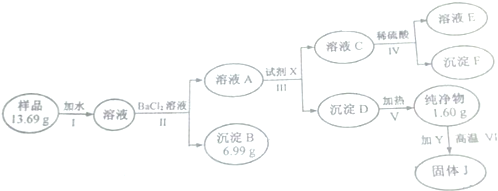
.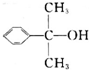 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是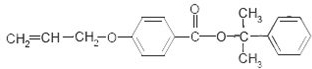 .
.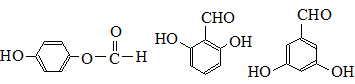 .
.