题目内容
6.在1L浓度为0.2mol•L-1Fe(NO3)3和1.5mol•L-1H2SO4组成的混合溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )| A. | 由于氧化性Fe3+>H+,故反应先不产生气体后产生气体 | |
| B. | 反应后产生13.44LH2(标准状况) | |
| C. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol | |
| D. | 反应后溶液中Fe3+物质的量为0.8mol |
分析 溶液中n(Fe3+)=0.2mol,n(NO3-)=0.6mol,n(H+)=3mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,由于氧化性为氧化性为HNO3>Fe3+>H+,先发生:Fe+4H++NO3-═Fe3++NO↑+2H2O,0.6molNO3-完全反应消耗0.6molFe,消耗2.4molH+,生成0.6molFe3+、0.6molNO,反应后剩余0.1molFe、0.6molH+,此时溶液中共有0.8molFe3+,再发生:Fe+2Fe3+═3Fe2+,0.1molFe反应消耗0.2molFe3+,生成0.3molFe2+,剩余0.6molFe3+,没有Fe剩余,不发生反应:Fe+2H+═Fe2++H2↑.
解答 解:溶液中n(Fe3+)=0.2mol,n(NO3-)=0.6mol,n(H+)=3mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,由于氧化性为氧化性为HNO3>Fe3+>H+,先发生:Fe+4H++NO3-═Fe3++NO↑+2H2O,0.6molNO3-完全反应消耗0.6molFe,消耗2.4molH+,生成0.6molFe3+、0.6molNO,反应后剩余0.1molFe、0.6molH+,此时溶液中共有0.8molFe3+,再发生:Fe+2Fe3+═3Fe2+,0.1molFe反应消耗0.2molFe3+,生成0.3molFe2+,剩余0.6molFe3+,没有Fe剩余,不发生反应:Fe+2H+═Fe2++H2↑.
A.由于氧化性为氧化性为HNO3>Fe3+>H+,先发生:Fe+4H++NO3-═Fe3++NO↑+2H2O,开始有气体生成,故A错误;
B.由上述分析可知,不发生反应:Fe+2H+═Fe2++H2↑.没有氢气生成,标况下生成的NO为0.6mol×22.4L/mol=13.44L,故B错误;
C.反应后溶液中存在0.6molFe3+、0.3molFe2+,反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol,故C正确;
D.反应后溶液中Fe3+物质的量为0.6mol,故D错误,
故选:C.
点评 本题考查混合物计算,关键是明确发生反应的先后顺序,再结合过量计算解答,难度中等.

 学业测评一课一测系列答案
学业测评一课一测系列答案 某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析: .
.
 .
.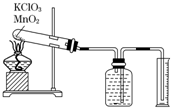 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2. CH3OH(g) △H<0
CH3OH(g) △H<0 CH4 (g)+H2O(g)
CH4 (g)+H2O(g)