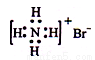题目内容
1.已知铁的相对原子质量是56,则1个铁原子的质量是$\frac{56}{6.02×1{0}^{23}}$g(列出式子即可).与16g氧气所含有分子数相同的氨气(NH3)在标准状况下的体积为11.2L.分析 Fe的摩尔质量为56g/mol,1molFe原子含有约6.02×1023个Fe原子,根据n=$\frac{m}{M}$计算氧气物质的量,再根据V=nVm计算氨气体积.
解答 解:Fe的摩尔质量为56g/mol,1molFe原子含有约6.02×1023个Fe原子,则1个铁原子的质量是 $\frac{56g}{6.02×1{0}^{23}}$=$\frac{56}{6.02×1{0}^{23}}$g,
16g氧气物质的量为$\frac{16g}{32g/mol}$=0.5mol,所含有分子数相同的氨气,而氨气物质的量为0.5mol,标况下氨气体积为0.5mol×22.4L/mol=11.2L,
故答案为:$\frac{56}{6.02×1{0}^{23}}$;11.2.
点评 本题考查物质的量计算,比较基础,注意掌握以物质的量为中心的计算.

练习册系列答案
相关题目
11.把Na2SO4放入足量水中,经充分搅拌后,将所得溶液用石墨电极进行电解,阳极生成的物质是( )
| A. | H2 | B. | Ag | C. | O2 | D. | Cl2 |
12.某无色溶液中,下列离子中能大量共存的一组为( )
| A. | K+、Mg2+、Cl-、OH- | B. | K+、Cu2+、SO42-、Na+ | ||
| C. | NH4+、CO32-、NO3-、Na+ | D. | NH4+、Cl-、HCO3-、H+ |
6.在1L浓度为0.2mol•L-1Fe(NO3)3和1.5mol•L-1H2SO4组成的混合溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )
| A. | 由于氧化性Fe3+>H+,故反应先不产生气体后产生气体 | |
| B. | 反应后产生13.44LH2(标准状况) | |
| C. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol | |
| D. | 反应后溶液中Fe3+物质的量为0.8mol |
10.下列对碱金属性质的叙述中,不正确的是( )
| A. | 都是银白色的柔软金属(除铯外) | |
| B. | 密度都比较小 | |
| C. | 碱金属单质都与水剧烈反应 | |
| D. | 单质的熔、沸点随原子序数的增加而升高 |
 已知:①CH2CH2Br+NaCN$\stackrel{醇}{→}$CH3CH2CN+NaBr;
已知:①CH2CH2Br+NaCN$\stackrel{醇}{→}$CH3CH2CN+NaBr;