题目内容
1.过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面.下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程.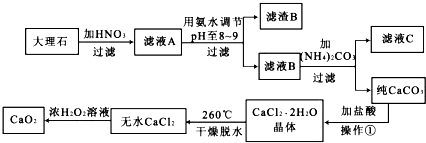
请回答下列问题:
(1)用氨水调节pH至8~9的目的是除去Fe3+.
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+是(填“是”或“否”)沉淀完全.(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+)<c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”).
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:CaCl2+H2O2=CaO2↓+2HCl,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀.用化学方程式和简要的文字解释需用氢氧化钠调节pH至9~11的原因加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成.
分析 大理石(主要杂质是氧化铁)与硝酸反应生成硝酸钙和硝酸铁,则滤液A的成分有硝酸钙和硝酸铁以及剩余的硝酸,当pH至8-9范围段内时,三价铁可易形成沉淀,所以滤渣B是氢氧化铁,滤液B是硝酸钙,和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤,沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,再失水成为无水氯化钙,双氧水可以和氯化钙反应生成过氧化钙和盐酸,
(1)pH至8-9范围段内时,三价铁可易形成沉淀;
(2)依据溶度积常数计算此时钙离子难度减小分析判断;
(3)酸化后溶液中,铵根离子水解;
(4)双氧水可以和氯化钙反应生成过氧化钙和盐酸;氢氧化钠溶液加入和盐酸反应促进平衡正向进行生成过氧化钙.
解答 解:根据图示信息可知:滤液A的成分有硝酸钙和硝酸铁以及剩余的硝酸,当pH至8-9范围段内时,三价铁可易形成沉淀,所以滤渣B是氢氧化铁,滤液B是硝酸钙,和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤,沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,再失水成为无水氯化钙,双氧水可以和氯化钙反应生成过氧化钙和盐酸,
(1)用氨水调节pH至8-9,三价铁可易形成沉淀,从而分离出硝酸钙溶液,
故答案为:除去Fe3+;
(2)若测得滤液C中c(CO32-)=10-3 mol/L,Ksp(CaCO3)=4.96×10-9;Ksp=Ca2++CO32-=10-3 mol/L×c(Ca2+)=4.96×10-9 ,c(Ca2+)=4.96×10-6 mol/L,已知c(Ca2+)≤10-5mol/L可视为沉淀完全,所以此时钙离子沉淀完全;
故答案为:是;
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,铵根离子水解,则酸化后溶液中c(NH4+)<c(NO3-);
故答案为:<;
(4)双氧水可以和氯化钙反应生成过氧化钙和盐酸,即CaCl2+H2O2=CaO2↓+2HCl,加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成;
故答案为:CaCl2+H2O2=CaO2↓+2HCl;加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成.
点评 本题考查了制备方案的设计,题目难度中等,明确制备流程为解答关键,注意掌握难溶物溶解平衡及沉淀转化的应用方法,试题有利于提高学生的分析能力及化学实验能力.

 互动英语系列答案
互动英语系列答案| A. |  向试管内加锌粒 | B. |  向试管内倒液体 | ||
| C. |  给试管内的液体加热 | D. |  用橡胶塞塞住试管 |
| A. | 催化剂 | B. | 氧化剂 | C. | 还原剂 | D. | 填充剂 |
| A. | A3BC2 | B. | A4B2C | C. | A8B3C3 | D. | A4B2C2 |
| A. | 结构示意图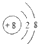 ,可以表示一种原子,也可以表示一种离子 ,可以表示一种原子,也可以表示一种离子 | |
| B. | 比例模型 可以表示二氧化碳分子,也可以表示二硫化碳分子分子 可以表示二氧化碳分子,也可以表示二硫化碳分子分子 | |
| C. | 电子式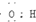 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 分子式C2H4O2:可以表示乙酸,也可以表示甲酸甲酯 |
| A. | 等体积等浓度的Na2S溶液和Na2SO3溶液中,离子数目以前者为多 | |
| B. | 已知室温时0.10mol/L NH4Cl溶液中c(H+)=7.5×10-6mol/L,室温时0.10mol/L KCN溶液中c (OH-)=1.3×10-3mol/L.那么此时0.10mol/L NH4CN溶液中pH>7 | |
| C. | 等pH、等体积的醋酸和硫酸,分别与足量的碳酸氢钠反应,在相同条件下,硫酸放出气体更多 | |
| D. | 醋酸加到氢氧化钠溶液中,若要使所得溶液呈中性,醋酸应稍过量 |
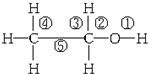
| A. | 乙醇与金属钠、乙酸、HBr的反应均是①处化学键断裂 | |
| B. | 乙醇燃烧时,①②③④⑤处化学键全部断裂 | |
| C. | 乙醇与浓硫酸170℃时反应,①③处化学键断裂 | |
| D. | 乙醇与氧化铜加热反应,①②③④⑤处化学键全部断裂 |
 ,Na在氧气中完全燃烧所得产物的电子式
,Na在氧气中完全燃烧所得产物的电子式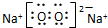
 土豪,原指地方上有钱有势的家族或个人、乡村中有钱的恶霸等,2013年土豪一词专指网络上无脑消费的人而成为流行语,将有望在2014年加入牛津词典.下图是土豪一词的拼音缩写,类似于某种有机物分子的键线式,若图中的线段可以表示单键或双键,请回答下列问题:
土豪,原指地方上有钱有势的家族或个人、乡村中有钱的恶霸等,2013年土豪一词专指网络上无脑消费的人而成为流行语,将有望在2014年加入牛津词典.下图是土豪一词的拼音缩写,类似于某种有机物分子的键线式,若图中的线段可以表示单键或双键,请回答下列问题: