题目内容
16.A、B、C三种短周期元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层数的3倍.由这三种元素组成的化合物的化学式不可能是( )| A. | A3BC2 | B. | A4B2C | C. | A8B3C3 | D. | A4B2C2 |
分析 有A、B、C三种短周期主族元素,A元素的原子最外层电子数等于其电子层数,所以A可能是H元素、Be元素、Al元素;B元素的原子最外层电子数是其电子层数的2倍,所以B可能是C元素、S元素;C元素的原子最外层电子数是其电子层数的3倍,原子只能有2个电子层,最外层电子数为6,所以C是O元素,结合常见物质化学式及化合价分析解答.
解答 解:有A、B、C三种短周期主族元素,A元素的原子最外层电子数等于其电子层数,所以A可能是H元素、Be元素、Al元素;B元素的原子最外层电子数是其电子层数的2倍,所以B可能是C元素、S元素;C元素的原子最外层电子数是其电子层数的3倍,原子只能有2个电子层,最外层电子数为6,所以C是O元素.
A.A表示+1、C表现-2价,化合物中各元素的化合价代数和为0,则A3BC2中B元素化合价为+1,不符合碳、硫元素化合价,故A错误;
B.A4B2C,化学式符合CH3CHO,可为乙醛,故B正确;
C.A8B3C3,化学式符合C3H8O3,为丙三醇,故C正确;
D.A4B2C2,化学式符合C2H4O2,为乙酸,故D正确.
故选A.
点评 本题考查了元素位置结构关系的应用,难度中等,能正确判断元素是解本题的关键,注意利用列举法解答.

练习册系列答案
相关题目
6.下列有关Na2CO3和NaHCO3性质的比较中,说法正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 常温时水溶性碱性:Na2CO3>NaHCO3 | |
| C. | 等质量的Na2CO3与NaHCO3与过量稀盐酸反应产生的CO2:Na2CO3>NaHCO3 | |
| D. | Na2CO3溶液能与Ca(OH)2溶液反应,而NaHCO3溶液不能与Ca(OH)2溶液反应 |
7.氧离子中电子的运动状态有( )
| A. | 3种 | B. | 8种 | C. | 10种 | D. | 12种 |
4.用含有少量镁的铝片制取纯净的Al(OH)3时,下列操作中最恰当的组合是( )
①加盐酸溶解 ②加NaOH溶液溶解 ③过滤 ④通入过量的CO2生成Al(OH)3
⑤加盐酸生成Al(OH)3 ⑥加过量的烧碱生成Al(OH)3.
①加盐酸溶解 ②加NaOH溶液溶解 ③过滤 ④通入过量的CO2生成Al(OH)3
⑤加盐酸生成Al(OH)3 ⑥加过量的烧碱生成Al(OH)3.
| A. | ①⑤⑥③ | B. | ①③⑥③ | C. | ②③④③ | D. | ②③⑤③ |
5.长周期中的某主族元素R,其原子核外最外电子层上只有1个电子,下列叙述中正确的是( )
| A. | R的单质常温下跟水反应不如钠剧烈 | |
| B. | R的碳酸盐易溶于水 | |
| C. | R的原子半径比钾的原子半径小 | |
| D. | R的氢氧化物不能使氢氧化铝溶解 |
6.下列说法正确的是( )
| A. | 已知:2H2(g)+O2(g)=2H2O(l)△H<0,反应物总能量小于生成物总能量 | |
| B. | 测定盐酸和氢氧化钠反应的中和热实验中,所用试剂可以是浓溶液 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则1molH2SO4和1molBa(OH)2反应放出的热量为114.6kJ | |
| D. | 已知C(s)与CO(g)的燃烧热分别为393.5kJ•mol-1、283.0kJ•mol-1,则相同条件下C(s)与O2(g)反应生成1molCO(g)的反应热为△H=-110.5kJ/mol |
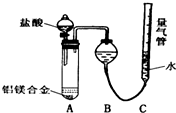 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.
 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: