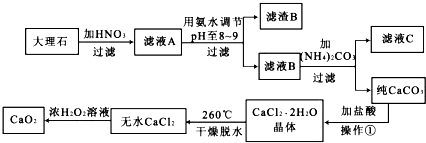
题目内容
11.月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库.(1)Na+结构示意图
 ,Na在氧气中完全燃烧所得产物的电子式
,Na在氧气中完全燃烧所得产物的电子式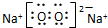
(2)足量的Mg在一定量的空气燃烧,发生反应的化学方程式为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$ 2MgO
(3)月球上某矿石经处理得到的MgO中含有SiO2,除去SiO2的离子方程式为SiO2+2OH-═SiO32-+H2O
(4)MgO与碳粉和氯气在一定的条件下反应可制备氯化镁.若尾气可用足量氢氧化钠溶液完全吸收.制备氯化镁的化学方程式为2MgO+C+2Cl2=CO2+2MgCl2,尾气吸收后生成盐的化学式为NaCl,NaClO,Na2CO3.
分析 (1)钠原子为11号元素,钠在氧气中燃烧生成过氧化钠,过氧化钠是过氧根离子和钠离子构成;
(2)镁在空气中燃烧生成氧化镁;
(3)氧化镁是碱性氧化物,二氧化硅酸式酸性氧化物,可以利用二氧化硅溶于氢氧化钠溶液除去;
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物.
解答 解:(1)钠原子为11号元素,钠离子核外10个电子: ,钠在氧气中燃烧生成过氧化钠,过氧化钠是过氧根离子和钠离子构成,电子式为:
,钠在氧气中燃烧生成过氧化钠,过氧化钠是过氧根离子和钠离子构成,电子式为: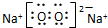 ;
;
故答案为: ,
,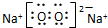 ;
;
(2)镁在空气中燃烧生成氧化镁,反应的化学方程式为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$ 2MgO,故答案为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$ 2MgO;
(3)氧化镁是碱性氧化物,二氧化硅酸式酸性氧化物,可以利用二氧化硅溶于氢氧化钠溶液除去,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O;
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应化学方程式:2MgO+C+2Cl2=CO2+2MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O,Cl2+2NaOH=NaCl+NaClO+H2O,产物为NaCl,NaClO,Na2CO3 ;
故答案为:2MgO+C+2Cl2=CO2+2MgCl2;NaCl,NaClO,Na2CO3 .
点评 本题考查了离子结构、离子方程式和化学方程式的书写,为高频考点,侧重于物质的性质的理解和应用的考查,注意相关基础知识的积累,难度不大.

| A. | 向4 mL FeCl2溶液中滴加两滴浓硝酸:Fe2++2H++NO${\;}_{3}^{-}$═Fe3++NO2↑+H2O | |
| B. | 向石灰水中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO${\;}_{3}^{-}$═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| C. | 铝与稀硫酸反应:Al+2H+═Al3++H2↑ | |
| D. | 向NH4 Al(SO4)2加入少量的NaOH溶液:NH${\;}_{4}^{+}$+OH-═NH3.H2O |
| A. | 1:20 | B. | 1:10 | C. | 20:1 | D. | 10:1 |
| A. | 钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色 | |
| B. | 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应 | |
| C. | 过氧化钠在潮湿空气放置一段时间变成白色粘稠物发生了2Na2O2+2H2O═4NaOH+O2反应 | |
| D. | 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气 |
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 常温时水溶性碱性:Na2CO3>NaHCO3 | |
| C. | 等质量的Na2CO3与NaHCO3与过量稀盐酸反应产生的CO2:Na2CO3>NaHCO3 | |
| D. | Na2CO3溶液能与Ca(OH)2溶液反应,而NaHCO3溶液不能与Ca(OH)2溶液反应 |
| A. | 有大量白雾产生的反应:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | |
| B. | 有白色沉淀生成的反应:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | |
| C. | 有溶液颜色变化的反应:Zn+2HCl═ZnCl2+H2↑ | |
| D. | 黑色固体变成红色固体的反应:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 |
①配制480mL0.1mol/L氢氧化钠溶液用500mL的容量瓶;
②用托盘天平称取5.85gNaCl固体;
③中和滴定操作时,消耗0.1000mol/L的盐酸23.0mL;
④用广泛pH试纸测得血液的pH=7.4;
⑤实验室用乙醇制乙烯时,为更好控制温度选择水浴加热法.
| A. | 只有①正确 | B. | 只有②错误 | C. | ①③④正确 | D. | ①②③④⑤全错 |
| A. | 该物质是Al(OH)3和Na2CO3的混合物 | |
| B. | 该物质属于复盐 | |
| C. | 该药剂适合胃溃疡患者服用 | |
| D. | 1 mol NaAl(OH)2CO3最多可消耗4 mol H+ |