题目内容
10.下列说法不正确的是( )| A. | 等体积等浓度的Na2S溶液和Na2SO3溶液中,离子数目以前者为多 | |
| B. | 已知室温时0.10mol/L NH4Cl溶液中c(H+)=7.5×10-6mol/L,室温时0.10mol/L KCN溶液中c (OH-)=1.3×10-3mol/L.那么此时0.10mol/L NH4CN溶液中pH>7 | |
| C. | 等pH、等体积的醋酸和硫酸,分别与足量的碳酸氢钠反应,在相同条件下,硫酸放出气体更多 | |
| D. | 醋酸加到氢氧化钠溶液中,若要使所得溶液呈中性,醋酸应稍过量 |
分析 A、都是二元弱酸根离子分步水解,但水解程度不同;
B、室温时0.10mol/L NH4Cl溶液中c(H+)=7.5×10-6mol/L,说明铵根离子水解溶液显酸性,室温时0.10mol/L KCN溶液中c (OH-)=1.3×10-3mol/L.说明CN-离子水解显碱性,CN-水解程度大于铵根离子,0.10mol/L NH4CN溶液显碱性pH>7;
C、醋酸存在电离平衡,溶液中氢离子浓度和硫酸溶液中氢离子浓度相同,加入碳酸氢钠,随反应进行醋酸又电离出氢离子,生成二氧化碳气体多;
D、醋酸和氢氧化钠恰好反应生成的醋酸钠溶液显碱性,若呈中性,需要醋酸过量;
解答 解:A、都是二元弱酸根离子分步水解,硫离子水解程度大,促进水的电离,则Na2S溶液溶液中离子数多,故A正确;
B、室温时0.10mol/L NH4Cl溶液中c(H+)=7.5×10-6mol/L,说明铵根离子水解溶液显酸性,室温时0.10mol/L KCN溶液中c (OH-)=1.3×10-3mol/L.说明CN-离子水解显碱性,CN-水解程度大于铵根离子,0.10mol/L NH4CN溶液中CN-离子水解程度大于铵根离子水解程度,溶液显碱性pH>7,故B正确;
C、醋酸存在电离平衡,溶液中氢离子浓度和硫酸溶液中氢离子浓度相同,加入碳酸氢钠,随反应进行醋酸又电离出氢离子,醋酸生成二氧化碳气体多,故C错误;
D、醋酸和氢氧化钠恰好反应生成的醋酸钠溶液显碱性,若呈中性,需要醋酸稍微过量,故D正确,
故选C.
点评 本题考查了盐类水解,弱电解质电离平衡影响因素的分析判断,主要是溶液酸碱性的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
20.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,化学式是NaAl(OH)2CO3关于该物质的说法正确的是( )
| A. | 该物质是Al(OH)3和Na2CO3的混合物 | |
| B. | 该物质属于复盐 | |
| C. | 该药剂适合胃溃疡患者服用 | |
| D. | 1 mol NaAl(OH)2CO3最多可消耗4 mol H+ |
5.长周期中的某主族元素R,其原子核外最外电子层上只有1个电子,下列叙述中正确的是( )
| A. | R的单质常温下跟水反应不如钠剧烈 | |
| B. | R的碳酸盐易溶于水 | |
| C. | R的原子半径比钾的原子半径小 | |
| D. | R的氢氧化物不能使氢氧化铝溶解 |
19.下列物质中,既有离子键又有共价键的是( )
| A. | MgCl2 | B. | Ca(OH)2 | C. | H2O | D. | C60 |
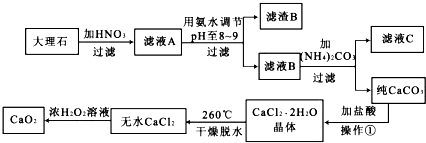
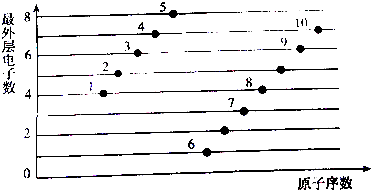
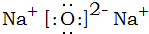
 .
.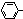 ):
):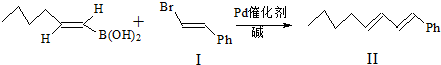
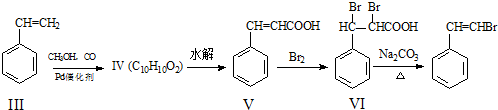
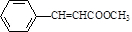 ,化合物V转化为化合物VI的反应类型为加成反应.
,化合物V转化为化合物VI的反应类型为加成反应. .
. 或
或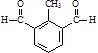 .
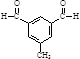
.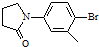 )与化合物(
)与化合物(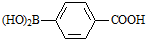 )能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式
)能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式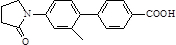 .
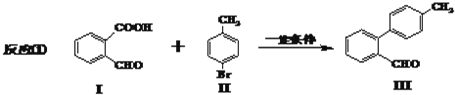
.
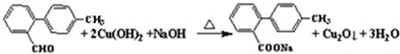 .
. (要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)