题目内容
12.在铜锌原电池中,锌电极上发生的反应为Zn-2e-=Zn2+,则下列说法正确的是( )| A. | 锌电极为电流流出 | B. | 锌电极为正极 | ||
| C. | 锌电极有气泡 | D. | 反应中Zn被氧化 |
分析 铜锌原电池中,较活泼的金属作负极,较不活泼的金属作正极,负极上Zn失电子发生氧化反应被氧化,电子从负极沿导线流向正极,电流方向与电子流向相反,Cu做正极,氢离子在正极得电子生成氢气,据此分析.
解答 解:A、Zn为负极,电流流入的电极,故A错误;
B、铜锌原电池中,较活泼的金属作负极,故B错误;
C、Cu做正极,氢离子在正极得电子生成氢气,故C错误;
D、负极上Zn失电子发生氧化反应被氧化,故D正确;
故选D.
点评 本题考查了原电池原理,难度不大,注意原电池中,较活泼的金属作负极,较不活泼的金属作正极.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
2. 近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )
 近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 1mol苹果酸和足量的钠反应生成1.5moL的H2 | |
| D. | 1mol苹果酸与Na2CO3溶液反应必需消耗2mol Na2CO3 |
4.按系统命名法,下列名称不正确的是( )
| A. | 2一甲基丁烷 | B. | 2一甲基丙烷 | C. | 2,2一二甲基丙烷 | D. | 2一乙基丙烷 |
1.在实验室里可按如图所示装置干燥并收集气体R,且吸收多余的R,则R是( )

| A. | CH4 | B. | NH3 | C. | HCl | D. | O2 |
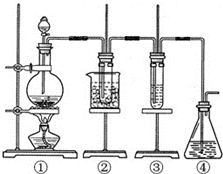 某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:
某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中: ;
; ;
;
 .
.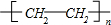 (或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
(或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).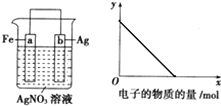 按如图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( )
按如图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( ) 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.