题目内容
20.现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构.已知:①常温下,F的单质是一种黄绿色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物G分子中含有10个电子,且可以发生下列转化:G$\stackrel{D的单质}{→}$P$\stackrel{D的单质}{→}$Q$\stackrel{H_{2}O}{→}$M+P,其中P为无色气体,Q为红棕色气体;
④E和D是同主族元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)B元素的名称是钠;
(2)E元素的原子结构示意图是
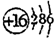 ;
;(3)请指出C元素元素周期表中位置:第二周期第VA族;
(4)G的电子式为
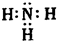 ;
;(5)化合物X所含化学键类型有离子键、共价键;
(6)①A的氧化物与NaOH溶液反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O;
②M的稀溶液与铜反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
分析 现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,
①常温下,F的单质是一种黄绿色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G$\stackrel{D的单质}{→}$P$\stackrel{D的单质}{→}$Q$\stackrel{H_{2}O}{→}$M+P,P为无色气体,Q为红棕色气体,则C是N元素,D为O元素,G为NH3,P为NO,Q为NO2,M为HNO3;
④E和D是同主族元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K,E为S元素,T为SO2,K为SO3;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,以此来解答.
解答 解:现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,
①常温下,F的单质是一种黄绿色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G$\stackrel{D的单质}{→}$P$\stackrel{D的单质}{→}$Q$\stackrel{H_{2}O}{→}$M+P,P为无色气体,Q为红棕色气体,则C是N元素,D为O元素,G为NH3,P为NO,Q为NO2,M为HNO3;
④E和D是同主族元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K,E为S元素,T为SO2,K为SO3;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,
(1)由以上分析可知B为钠元素,故答案为:钠;
(2)E为S元素,原子核外有3个电子层,最外层电子数为6,原子结构示意图为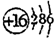 ,故答案为:
,故答案为: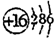 ;
;
(3)C是N元素,位于周期表第二周期第VA族,故答案为:第二周期第 VA族;
(4)G为NH3,电子式为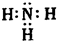 ,故答案为:
,故答案为: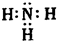 ;
;
(5)X为Na2O2,含有离子键和共价键,故答案为:离子键、共价键;
(6)①A是Al元素,氧化物与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
②M为硝酸,具有强氧化性,稀硝酸与铜反应生成NO,反应的方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,元素的推断为解答的关键,注意元素化合物知识在推断中的应用,侧重分析与推断能力的考查,题目难度中等.

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案| A. | 酸和醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | 实验证实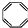 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | DDT的结构简式为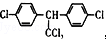 ,分子中最多有14个碳原子共平面 ,分子中最多有14个碳原子共平面 | |
| D. |  的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
| A. | 金属间在溶液中发生置换反应 | |
| B. | 1 mol金属单质在反应中失去电子的多少 | |
| C. | 金属元素的最高价氧化物的水化物的碱性强弱 | |
| D. | 金属单质与水或酸置换出氢气的难易 |
| A. | 符合上述条件的甲共有3种 | |
| B. | 1mol甲最多可以和7molH2发生反应 | |
| C. | 乙中的所有原子一定共平面 | |
| D. | 分别燃烧1mol乙与1mol苯耗氧量相同 |
| A. | 锌电极为电流流出 | B. | 锌电极为正极 | ||
| C. | 锌电极有气泡 | D. | 反应中Zn被氧化 |
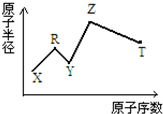 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点排序:Y>T>R | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显酸性 |
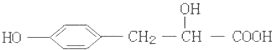
| A. | ①②③⑤⑥⑦ | B. | ②③④⑥⑧ | C. | ①②③④⑥ | D. | ③⑤⑥⑦⑧ |