题目内容
【题目】已知25℃时,几种常见弱电解质的电离平衡常数如下表所示:
电解质 | H3PO4 | NH3·H2O | C6H5OH |
电离平衡常数 | K1=7.5×10-3 K2=7.5×10-8 K3=7.5×10-13 | 1.7×10-5 | 1.1×10-10 |
下列说法正确的是
A. NaH2PO4溶液呈碱性
B. 25℃时,0.1moL/L氨水的pH=11+lg1.7
C. 足量C6H5OH与Na3PO4反应的离子方程式为:2C6H5OH+PO43-=H2PO4-+2C6H5O-
D. 25℃时,将等体积等浓度的苯酚溶液与氨水混合,混合溶液中各离子浓度关系:c(C6H5O-)>c(NH4+)>c(OH-)>c(H+)
【答案】B
【解析】H2PO4-水解平衡常数是![]() ,H2PO4-水解平衡常数小于H3PO4的K1,电离大于水解,所以NaH2PO4溶液呈酸性,故A错误;设0.1moL/L氨水中c(OH-)=xmol/L,则
,H2PO4-水解平衡常数小于H3PO4的K1,电离大于水解,所以NaH2PO4溶液呈酸性,故A错误;设0.1moL/L氨水中c(OH-)=xmol/L,则![]() ,x=
,x=![]() moL/L, c(H+)=
moL/L, c(H+)=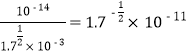 ,所以PH=11+lg1.7,故B正确;C6H5OH的电离平衡常数大于H3PO4的K3,小于H3PO4的K2,所以足量C6H5OH与Na3PO4反应的离子方程式为C6H5OH+PO43-=HPO42-+C6H5O-,故C错误;NH3·H2O电离程度大于C6H5OH,25℃时,将等体积等浓度的苯酚溶液与氨水混合,混合溶液呈碱性,各离子浓度关系c(NH4+)>c(C6H5O-)> c(OH-)>c(H+),故D错误。
,所以PH=11+lg1.7,故B正确;C6H5OH的电离平衡常数大于H3PO4的K3,小于H3PO4的K2,所以足量C6H5OH与Na3PO4反应的离子方程式为C6H5OH+PO43-=HPO42-+C6H5O-,故C错误;NH3·H2O电离程度大于C6H5OH,25℃时,将等体积等浓度的苯酚溶液与氨水混合,混合溶液呈碱性,各离子浓度关系c(NH4+)>c(C6H5O-)> c(OH-)>c(H+),故D错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】三氯化氧磷(POCl3)常用作半导体掺杂剂,实验室制取POCl3并测定产品质量的实验过程如下,据此回答下列问题:
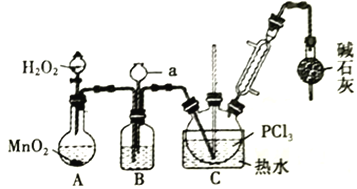
Ⅰ.氧化液态PCl3法制备POCl3:
资料i:有关试剂的性质及实验装置(加热及夹持装置省略)如下:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者均为无色液体,相互溶解;遇水均剧烈水解为两种酸。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)A 中反应时,MnO2的作用是_________________;仪器a的名称为_________________;
(2)盛有浓硫酸的装置B,其作用除观察O2的流速之外,还有_________________;
(3)实验时应控制反应温度在60~65℃,温度不宜过高的原因是_________________;;如果撤去装有碱石灰的干燥管,则可能降低POCl3的产量,原因是_________________________________(用化学方程式表示,任写一个)。
Ⅱ.沉淀滴定法测定POCl3质量:
资料ii :Ag3PO4为黄色沉淀,易溶于硝酸;
iii:Ag++SCN-=AgSCN↓,且Ksp(AgSCN) <Ksp(AgCl)。
实验步骤如下:
①将三颈烧瓶中的产品POCl3去除杂质,溶于60.00mL蒸馏水中,搅拌使其完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.8mol/L AgNO3标准溶液;
③加入少量硝基苯,用力摇动,使沉淀表面覆盖硝基苯;
④加入2~3 滴硫酸铁溶液作指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去10,00mL KSCN溶液。
(4)达到终点时的现象是______________________________;
(5)所得产品POCl3的质量为____________(结果保留两位小数);若取消步骤③,则所得结果将______________(填“ 偏高”、“ 偏低”或“不变”)。
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10﹣5 | K1=4.3×10﹣7 | K1=9.1×10﹣8 | K1=7.5×10﹣3 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸, ![]() 增大
增大
D.向弱酸溶液中加少量NaOH溶液,电离常数不变