题目内容
【题目】某温度下,向一定体积0.1mol/L一元弱酸HA溶液中逐滴加入等浓度的NaOH 溶液,溶液中pH与pOH[pOH=-lgc(OH-) 的变化关系如右图所示。下列说法错误的是
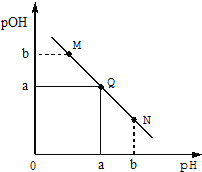
A. 该温度下,水的离子积常数为1.0×10-2a
B. M、N 两点所示的溶液中,水的电离程度相同
C. Q点消耗的NaOH 溶液的体积等于HA 溶液的体积
D. N 点溶液加水稀释,![]() 减小
减小
【答案】C
【解析】A项,水的离子积常数表达式为Kw=c(H+)c(OH-),可利用图中Q点数据求得Kw,pH+pOH=-lgc(H+)+[-lgc(OH-)]-lg[c(H+)c(OH-)]=2a,则Kw=c(H+)c(OH-)=1.0×10-2a,故A正确;B项,M点溶液pOH>pH,即c(H+)>c(OH-),溶液呈酸性,说明溶液中HA是过量的,HA电离抑制水的电离,此时溶液中由水电离的c(H+)水=c(OH-)水=c(OH-)=10-bmol/L,N点溶液pH>pOH,即c(OH-)>c(H+),溶液呈碱性,此时溶液中水电离的c(H+)水=c(OH-)水=c(H+)=10-bmol/L,综上分析,M、N两点所示的溶液中,水的电离程度相同,故B正确;C项,Q点溶液pH=pOH,即c(H+)=c(OH-),溶液呈中性,因为HA为弱酸,所以NaA会发生水解使溶液呈碱性,则当溶液呈中性时,消耗的NaOH溶液的体积小于等浓度HA溶液的体积,故C错误;D项,N点pH>pOH,即c(H+)<c(OH-),溶液为碱性,HA的电离平衡常数表达式为Ka=c(H+)c(A-)/c(HA),则溶液中c(A-)/c(HA)=Ka/c(H+),碱性溶液加水稀释,溶液中c(OH-)减小,因为Kw不变,则c(H+)增大,所以c(A-)/c(HA)=Ka/c(H+)减少,故D正确。

【题目】已知25℃时,几种常见弱电解质的电离平衡常数如下表所示:
电解质 | H3PO4 | NH3·H2O | C6H5OH |
电离平衡常数 | K1=7.5×10-3 K2=7.5×10-8 K3=7.5×10-13 | 1.7×10-5 | 1.1×10-10 |
下列说法正确的是
A. NaH2PO4溶液呈碱性
B. 25℃时,0.1moL/L氨水的pH=11+lg1.7
C. 足量C6H5OH与Na3PO4反应的离子方程式为:2C6H5OH+PO43-=H2PO4-+2C6H5O-
D. 25℃时,将等体积等浓度的苯酚溶液与氨水混合,混合溶液中各离子浓度关系:c(C6H5O-)>c(NH4+)>c(OH-)>c(H+)