题目内容
13.短周期元素A、B、C、D、E、F六种主族元素,原子序数依次增大.A元素的核外电子数等于电子层数;B元素原子的最外层电子数是次外层电子数的2倍;D元素是地壳中含量最高的元素;E元素原子最外层只有1个电子,F与D元素处在同一主族.(1)元素符号:A是H、B是C、D是O E是Na;
(2)C元素位置:第二周期VA 族.
(3)A元素分别与B、C、D元素形成简单氢化物的化学式依次为CH4、NH3、H2O,稳定性最强的是H2O.
(4)A、C、D形成的化合物是离子(或共价) 化合物(填写“离子”或“共价”),含离子键和共价(或共价) 键.
分析 短周期元素A、B、C、D、E、F六种主族元素,原子序数依次增大,B原子的最外层电子数是次外层电子数的2倍,则B为C元素;D是地壳中含量最高的元素,则D为O元素;C的原子序数大于C小于O,则C为N元素;A元素的核外电子数等于电子层数,则A为H元素;E元素原子最外层只有1个电子,则E为Na元素;F与D元素处在同一主族,则F为S元素,据此结合元素周期律知识进行解答.
解答 解:短周期元素A、B、C、D、E、F六种主族元素,原子序数依次增大,B原子的最外层电子数是次外层电子数的2倍,则B为C元素;D是地壳中含量最高的元素,则D为O元素;C的原子序数大于C小于O,则C为N元素;A元素的核外电子数等于电子层数,则A为H元素;E元素原子最外层只有1个电子,则E为Na元素;F与D元素处在同一主族,则F为S元素,
(1)根据分析可知,A为H元素、B为C元素、D为O元素、E为Na元素,故答案为:H; C;O;Na;
(2)C为N元素,原子序数为7,位于周期表中第二周期VA族,故答案为:二;VA;
(3)A为H元素,H分别与B、C、D元素形成简单氢化物的化学式依次为:CH4、NH3、H2O,元素的非金属性越强,其气态氢化物的稳定性越强,则稳定性最强的为水,
故答案为:CH4、NH3、H2O;H2O;
(4)A、C、D形成的化合物为硝酸铵或硝酸,若为硝酸铵,则属于离子化合物,其化学式中含有离子键和共价键;若为硝酸,则属于共价化合物,含有共价键,
故答案为:离子(或共价);离子键和共价(或共价).
点评 本题考查了位置、结构与性质的关系,题目难度中等,正确推断各元素名称为解答关键,注意掌握元素周期表结构、元素周期律的内容,试题侧重考查学生的分析、理解能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列微粒与Na+具有相同的质子数和电子数的是( )
| A. | Ne | B. | NH4+ | C. | F- | D. | H2O |
4.下列说法中,正确的是( )
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,离子半径越小 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
1.氯化钠是日常生活中人们常用的调味品.是下列事实中,可以证明NaCl中一定存在离子键的是( )
| A. | 水溶液能导电 | B. | 易溶于水 | C. | 熔化时能导电 | D. | 有较高的熔点 |
8.下列物质中含有共价键的离子化合物的是( )
| A. | NaI | B. | CaCl2 | C. | CO2 | D. | KOH |
18.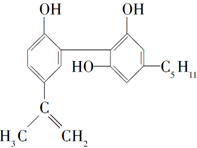 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下.关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下.关于它的说法正确的是( )
 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下.关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下.关于它的说法正确的是( )| A. | 它的化学式为C19H26O3 | |
| B. | 该化合物只能发生取代反应 | |
| C. | 从结构上看,它属于醇类 | |
| D. | 从元素组成上看,它可以在氧气中燃烧生成CO2和水 |
5.A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素名称:氮、硫、氟.
(2)B位于周期表中第三周期第ⅥA族.
(3)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
| A | C | |
| B |
(2)B位于周期表中第三周期第ⅥA族.
(3)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
2.已知自然界氧的核素有16O、8O,氢的核素有 H、D,从水分子的原子组成来看,自然界的水一共有( )
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 12种 |
3.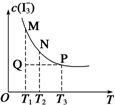 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )| A. | 反应速率:vM>vP | B. | 平衡常数:KN<KP | ||
| C. | M、N两点相比,M点的c(I-)大 | D. | Q点时,v正>v逆 |